博文
危重症患者的氧疗目标:从病理生理学到人群富集策略
||

危重症患者的氧疗目标:从病理生理学到人群富集策略
Claudio Ripa¹, Laveena Munshi²,³,⁴, Wolfgang M. Kuebler⁵,⁶,⁷,⁸,⁹, Aurora Magliocca¹⁰, Fabio S. Taccone¹¹, Lorraine B. Ware¹²,¹³, Giuseppe Citerio¹,¹⁴, John G. Laffey¹⁵,¹⁶, Emanuele Rezoagli¹,¹⁷,*
1意大利米兰比可卡大学医学院外科
2加拿大多伦多大学西奈健康系统/大学健康网络重症医学系跨部门分部
3加拿大多伦多西奈健康系统和大学健康网络医学部
4加拿大多伦多西奈山医院
5德国柏林夏里特医科大学(Charité-Universitätsmedizin)生理学研究所
6德国柏林心血管研究中心
7加拿大多伦多大学外科
8加拿大多伦多大学医学院生理学系
9加拿大多伦多圣迈克尔医院基南研究中心
10意大利米兰大学病理生理学与移植学系
11比利时布鲁塞尔自由大学(ULB)布鲁塞尔大学医院(HUB)重症监护科
12美国田纳西州纳什维尔范德堡大学医学中心医学部
13美国田纳西州纳什维尔范德堡大学病理学、微生物学和免疫学系
14意大利蒙扎圣杰拉尔多·德伊廷托里基金会(Fondazione IRCCS San Gerardo dei Tintori)神经科学系
15爱尔兰戈尔韦大学医院麻醉与重症医学科
16爱尔兰戈尔韦大学医学院麻醉学系、医学、护理与健康科学学院以及CÚRAM医疗器械研究中心
17意大利蒙扎圣杰拉尔多·德伊廷托里科学研究医院(Fondazione Istituto di Ricovero e Cura a Carattere Scientifico,IRCCS)急诊与重症监护科
*通讯作者:Emanuele Rezoagli,医学博士、哲学博士,emanuele.rezoagli@unimib.it
摘要
吸氧疗法广泛用于提高氧输送,治疗或预防低氧血症;然而,需要谨慎管理以避免过度吸氧带来的有害影响。高氧(吸入氧分数超过0.21)和高氧血症(动脉血氧分压 [PaO2]>100 mmHg )都可能导致肺损伤、促进全身血管收缩,并增加活性氧(ROS)的生成,进而损害大分子和细胞功能。相反,在某些情况下,高氧血症可能有益,比如在高动力性休克中稳定血流动力学、免疫调节和杀菌作用。文献中关于不同氧疗目标(即 PaO2 和 / 或外周血氧饱和度 [SpO2] )对急性危重症患者(如急性呼吸窘迫综合征、脓毒症、心脏骤停和急性中枢神经系统损伤)短期和长期预后的影响存在相互矛盾的证据。这些差异可能源于随机试验中使用的氧合目标差异较小、 PaO2 和 SpO2 目标的生理局限性(它们反映的是血氧含量而非氧输送)、缺乏对微血管功能或氧输送的测量,以及治疗反应的异质性。此外,先进的分析方法(如机器学习)正成为实施人群富集策略的有前景的工具。通过优化患者亚组识别,这些方法可以显著优化精准医疗,实现更符合个体患者特征的个性化氧疗 。
关键词
重症监护;高氧血症;高氧;低氧血症;缺氧;机器学习;氧输送;氧气;人群富集;精准医疗;活性氧
引言
大约30亿年前,一些微生物能够利用光能产生氧气(O2),这使得空气中的氧气逐渐增多。在大约24亿年前的大氧化事件中,地球大气中的氧气分压突然从10 mmHg 上升到150 mmHg,促使线粒体的形成。线粒体能够通过呼吸链中氧气的还原作用产生三磷酸腺苷(ATP)[1]。从那时起,大气中的氧气通过氧气的可利用性和组织供氧之间的复杂平衡,对需氧生物产生影响。从那时起,人类开发了新的工具来处理低氧血症。对于低氧患者,吸氧是一种挽救生命的治疗方法,已经有一个多世纪的历史,旨在维持足够的组织氧输送[2]。尽管组织缺氧的危害广为人知,但肺部(主要暴露部位)和所有器官暴露于高氧水平及由此产生的过度氧化应激的影响在一定程度上却未得到充分认识。
在这篇叙述性综述中,我们研究了目前关于危重症患者不同氧合目标与预后相关的证据,强调了现有文献的局限性,并确定了关键的改进领域,以支持个性化管理策略的发展 。
检索策略
我们使用MEDLINE数据库进行文献检索,重点检索2000年1月至2024年12月期间发表的英文全文文章。主要关注人体研究,包括健康志愿者和患者,同时在相关情况下纳入哺乳动物模型的数据,以增强对病理生理机制的理解和背景知识。检索策略使用了特定的关键词,包括 “氧气”、“高氧”、“高氧血症”、“缺氧”、“低氧血症”、“氧输送”、“活性氧”、“重症监护”、“精准医疗”、“人群富集” 和 “机器学习”,以识别相关的出版物。我们根据不同器官的特定综合征和病理(如急性呼吸窘迫综合征、急性心肌梗死和创伤性脑损伤)进一步优化参考文献,确保对文献进行有针对性和全面的探索。系统筛选具有代表性的文章,综合现有证据,旨在突出当前的知识状态并找出潜在的知识差距,从而为未来的研究和重症监护的实际进展提供见解 。
补充氧气治疗细胞缺氧的复杂性
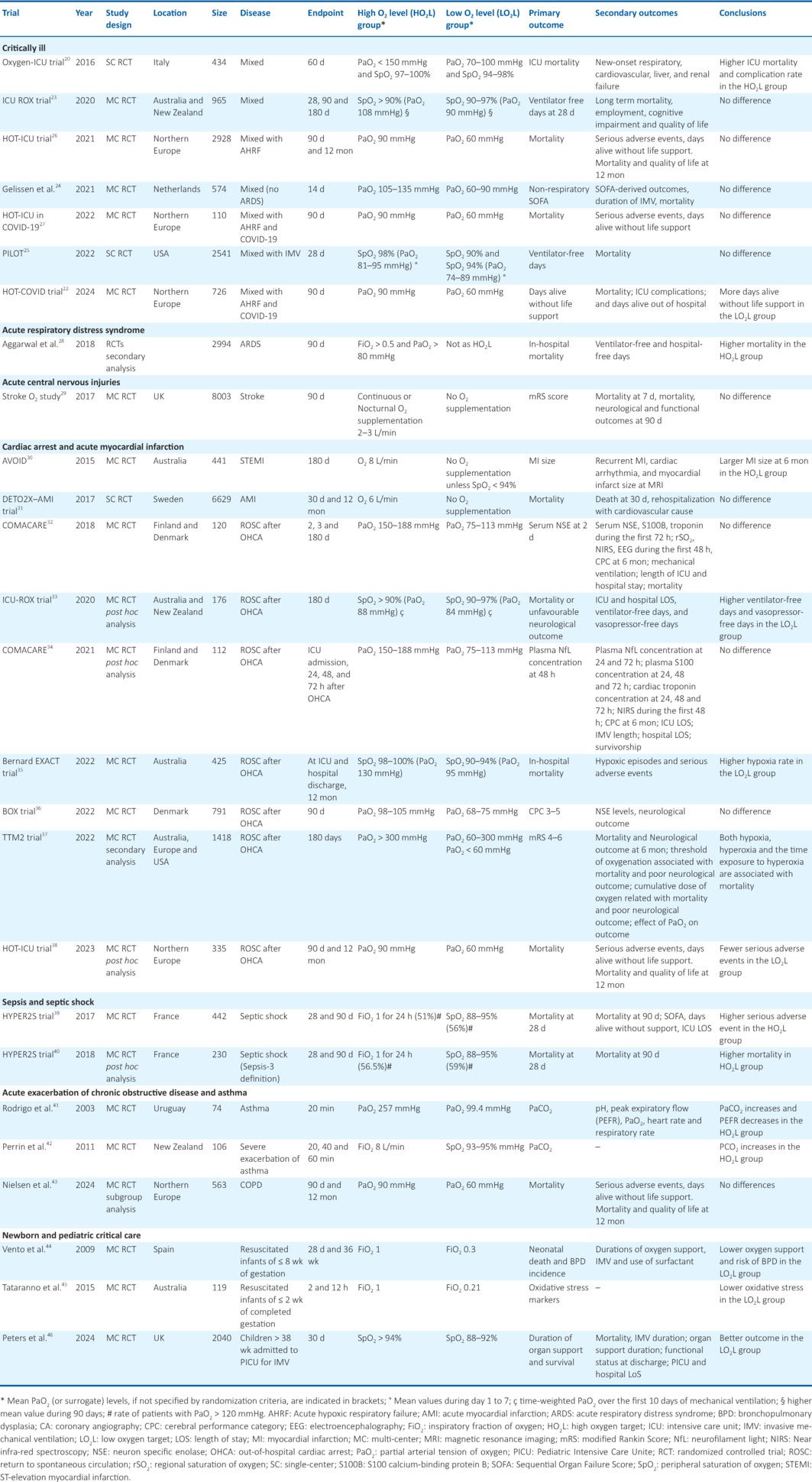
缺氧是指组织氧供应不足,可能导致细胞死亡。对缺氧患者补充氧气的目的是优化氧输送(DO2 ,即每分钟输送到组织的氧气毫升数),以避免细胞缺氧(图1)[3,4]。这对于维持线粒体呼吸链功能至关重要,线粒体在PO2 低至0.3 - 0.7 mmHg的水平下仍能发挥作用[5,6]。DO2 是心输出量和动脉血氧含量(CaO2)的乘积。因此,只要组织血流保持稳定,补充氧气主要是为了增加 CaO2 。由于测量细胞缺氧具有挑战性,临床医生依赖于血液氧含量等替代指标。CaO2 由三个关键因素决定:溶解氧、血红蛋白浓度(Hb)和氧饱和血红蛋白的百分比。监测氧饱和血红蛋白具有可连续获取、一目了然的优势。而动脉溶解氧则需要进行有创动脉血检测。这两个参数通过氧 - 血红蛋白解离曲线相互关联。血红蛋白对氧气的亲和力受多种因素影响,包括pH值。pH值通过波尔效应影响血红蛋白 - 氧亲和力,低pH值促进氧气向代谢活跃的组织释放。其他影响因素包括二氧化碳分压、温度和2,3 - 二磷酸甘油酸(在高海拔地区产生量增加) 。

图1:如上述公式所示,氧输送(DO₂)可通过调整氧气供应、血红蛋白(Hb)水平和心输出量来优化。调节氧气供应存在两大风险:一是低氧血症,即氧气水平不足以满足组织需求(缺氧);二是高氧血症,它会因活性氧(ROS)的产生而导致肺损伤和全身氧化应激。这种关系凸显了氧气供应的双刃剑特性之间的微妙平衡,二者都可能影响死亡率。改编自Martin等人的研究[3],比较不同氧疗目标下ICU患者生存结局的关键随机对照试验(RCTs),其氧分压(PaO₂)范围往往落在一个区间(黄色框)内,在该区间内,PaO₂与死亡率之间的U型关系(如Helmerhorst等人所述[4])处于一个死亡率较低的平稳阶段。此外,氧合血红蛋白解离曲线(ODC)的S形特征以及外周血氧饱和度(SpO₂)受多种因素影响的变异性(橙色框),降低了SpO₂本身的可靠性以及不同研究之间的可比性。底部的方框总结了不同危重症临床情况下的临床发现和知识空白。使用Clip Studio Paint 1.5和Microsoft Power Point(2021)创建。2,3-BPG:2,3-二磷酸甘油酸;ABG:动脉血气分析;AIH:急性间歇性缺氧;AMI:急性心肌梗死;ARDS:急性呼吸窘迫综合征;BPD:支气管肺发育不良;CO₂:二氧化碳;COPD:慢性阻塞性肺疾病;DO₂:氧输送;ECMO:体外膜肺氧合;FiO₂:吸入氧分数;Hb:血红蛋白;HBOT:高压氧治疗;HR:心率;ICU:重症监护病房;O₂:氧气;NEC:坏死性小肠结肠炎;NLS:新生儿生命支持;ODC:氧合血红蛋白解离曲线;pCO₂:二氧化碳分压;pH:酸碱度;pO₂:氧分压;PTs:患者;ROS:活性氧;SCI:脊髓损伤;SO₂:氧饱和度;SV:每搏输出量;RCT:随机对照试验;ROP:早产儿视网膜病变;TBI:创伤性脑损伤。
然而,DO2 和 CaO2 之间的关系可能会引起误解。例如,由于低氧血症(定义为PaO2<60 mmHg )导致的低 CaO2 并不一定导致缺氧,如在高原生理状态下,尽管空气中氧分压较低,但氧输送仍能得到保证。此外,由于高氧血症(PaO2>100 mmHg )导致的高 CaO2 并不能降低组织缺氧的风险,如在极端心输出量受损的情况下 。
补充氧气是否存在相关风险?
在危重症患者中,是否存在一个单一的最佳氧合水平以实现最有利的结果仍不清楚。近期的重症监护建议[8]指出,所有患者在吸氧过程中外周血氧饱和度(SpO2)的上限目标为96%,常见的目标范围是 SpO2 90 - 94% 。这些临床建议是基于近期关于过度吸氧风险的证据制定的,旨在为避免对 SpO2 正常的患者进行不必要的支持提供实用指导。氧合目标的选择应在个体患者层面上权衡益处和风险。较低的氧合目标可能会使患者面临因动脉低氧血症导致组织缺氧的风险。相反,较高的氧合目标可能会带来严重的安全风险,包括高氧(例如,高吸入氧分数 [FiO2]>0.21 )和高氧血症(例如,PaO2>100 mmHg ) 。
高氧会损伤气道黏膜和肺泡。高氧诱导的急性肺损伤动物模型表明,连续3 - 6天吸入FiO2>0.7会显著影响肺功能,可能导致因进行性呼吸衰竭而死亡。这强调了一种剂量 - 反应效应,既取决于 FiO2 水平,也取决于暴露持续时间。
组织病理学检查显示,肺泡 - 毛细血管膜通透性增加、急性渗出性肺水肿,随后是纤维增殖期、肺表面活性物质功能障碍、上皮增厚、黏液纤毛清除功能降低、中性粒细胞浸润和促炎介质释放。在同时接受非保护性机械通气的动物模型中,这些发现更为严重。然而,种间和种内的差异表明遗传易感性存在差异,这限制了这些结果的普遍性 。健康人志愿者在吸入 FiO2>0.75 超过12小时后,会出现咳嗽、黏膜刺激、胸部不适和肺不张等症状,还会出现呼吸困难、感觉异常、头痛、恶心和呕吐。健康受试者在吸入 FiO2>0.50 17 - 45小时后,支气管肺泡灌洗液显示出早期肺泡损伤和血管通透性增加的迹象 [9,10] 。在20世纪后半叶,有报道称,机械通气超过10天且 FiO2>0.9 的患者出现严重的肺部病变,这些发现与高氧诱导的急性肺损伤动物模型的描述非常相似,包括典型的渗出性肺损伤。然而,即使是作者也警告说,通气压力和容量方案以及呼吸衰竭的主要原因等因素可能会干扰对因果关系的进一步解释[11] 。最近的通气策略,特别是呼气末正压滴定,以及技术进步,减少了对高 FiO2 暴露的需求,可能大大降低了与高氧相关的额外风险[9] 。除了内皮紊乱和肺泡渗出性损伤,高氧还可通过肺泡内脱氮作用导致肺不张[12],这些效应会加剧未氧合血液的分流,进一步损害气体交换,恶化整体肺功能[13] 。
高氧血症可主要通过线粒体对氧气的不完全还原,加剧活性氧(ROS)的产生。ROS能够改变有机大分子的结构,损害其功能。如果调节不当,氧化应激可通过激活各种激酶和信号通路加剧炎症反应。在线粒体功能障碍的情况下,这种情况更为明显[14],因为线粒体功能障碍本身就会产生ROS 。此外,氧化应激被认为是多种疾病的关键因素,如癌症、动脉粥样硬化、心血管疾病、慢性神经系统疾病(如阿尔茨海默病)和肺部疾病[15] 。虽然高氧血症的定义是 PaO2>100 mmHg ,但组织高氧并没有明确的阈值,这取决于灌注和组织代谢活动 。
因此,尽管组织缺氧可能有害,但高氧血症也可能存在风险。值得注意的是,真核生物已经进化出机制来保护自己免受低氧血症和高氧血症的伤害。例如,在胎儿发育过程中,缺氧诱导因子1亚基α会表达,通过促进红细胞生成和新生血管形成来对抗缺氧的有害影响[16] 。类似地,在胎儿发育的后期阶段,酶促和非酶促抗氧化机制(如超氧化物歧化酶、谷胱甘肽和硫氧还蛋白)被激活,以支持新生儿在首次呼吸后适应 PaO2 的突然增加(从40 - 50 mmHg增加到70 - 80 mmHg),这会导致ROS产生急剧增加 。
高氧血症的定义:以动脉血氧分压还是外周血氧饱和度为目标?
定义高氧血症的任意临界值削弱了近期研究结果的普遍性。对于在每项研究中定义氧合水平的最佳变量,如 PaO2 、SpO2 或复合目标,存在不同的观点[17] 。如前所述,这些氧合目标是血氧含量的测量指标,实际上只是氧输送的替代指标。此外,SpO2 测量可能无法可靠地估计实际的 PaO2 ,而 PaO2 是决定高氧血症和ROS产生的因素[18] 。而且,PaO2-SpO2 关系(由S形的氧 - 血红蛋白解离曲线描述)存在固有局限性:当 PaO2 高于120 mmHg时,SpO2 变化很小(达到平台期),并且在影响重症监护病房(ICU)患者的多种情况下,氧 - 血红蛋白亲和力可能会有很大差异。此外,SpO2 测量可能会受到外周灌注不良、皮肤寒冷或皮肤色素沉着等因素的影响,从而降低其可靠性 。
一种更可靠的方法可能是测量高氧水平的累积暴露量。这强调了剂量和高于临界阈值的持续时间的重要性,而不是仅仅依赖于单个时间点的数据。此外,缺乏组织氧合测量严重限制了我们对氧暴露与患者预后之间复杂相互作用的理解,这种相互作用可能因局部微血管功能而异,难以预测 。
危重症患者的氧疗目标和预后:哪些患者亚组?
如下所述,大多数针对不同氧合目标的随机对照试验(RCT)在平均治疗效果方面存在争议,在很大程度上未能解决现有的不确定性。鉴于氧疗的广泛应用,临床医生越来越有兴趣通过进一步的RCT来探索这一主题。然而,需要考虑不同氧疗目标在危重症患者不同亚群中的影响 。
未分化的危重症患者群体
De Jonge等人[19]观察到,在3000名接受机械通气的ICU患者队列中,入院后24小时内的 PaO2 与医院死亡率之间存在U形关联 。随后的Oxygen-ICU试验[20]在一大群ICU患者中,测试了一种保守的氧疗补充干预方案的效果,该方案旨在使用最低的 FiO2 维持 SpO2 在94% - 98% 或 PaO2 在70 - 100 mmHg(中位 PaO2 87 mmHg),并与对照组的自由氧疗方案进行对比,对照组的目标是 SpO2 在97% - 100% 且 PaO2 高达150 mmHg(中位 PaO2 102 mmHg) 。干预组的ICU死亡率相比对照组几乎减半,同时次要结局(即新的休克发作、肝衰竭和新的血流感染发生率)也有所改善。随后的一项荟萃分析[21]证实了这些观点,该分析纳入了25项RCT,涉及超过16000名因各种病因入住ICU的患者 。然而,其他主要的RCT并未得出相同的结果[22 - 25] 。Nielsen等人[22]发现,保守的氧供应(目标 PaO2 为60 mmHg)对无生命支持的存活天数中位数(例如,主要结局)有有益影响,但对死亡率没有影响 。然而,自由氧疗组(目标 PaO2 为90 mmHg)在研究期间很少超过 PaO2 100 mmHg。相比之下,ICU-ROX试验[23]和Gelissen等人[24]并未发现,将患者随机分配到自由氧疗组(分别为 SpO2>91 % 和 PaO2 105 - 135 mmHg)与保守氧疗组(SpO2 91 - 97% 和 PaO2 60 - 90 mmHg)在死亡率(次要终点)上有显著差异 。在Semler等人[25]进行的PILOT试验中,接受机械通气的患者被随机分配到三个不同的 SpO2 目标组(低:90%;中:94%;高:98%),而不是特定的 PaO2 范围 。不同氧疗目标组的28天院内死亡率相似,其他并发症发生率也相似 。
这些研究比较的一个局限性在于,自由氧疗和保守氧疗目标的定义存在差异,且评估的人群具有异质性(表1)[20,22 - 46] 。Martin等人在一篇社论中对这些关于不同氧合目标对RCT临床结局影响的看似矛盾的结果进行了巧妙的解释[3](图1) 。作者表明,主要ICU RCT治疗组的氧合目标范围落在与 PaO2 水平相关的院内死亡调整概率曲线的平坦部分,正如Helmerhorst等人所描述的那样[4] 。在这个平坦区域,死亡风险最低,这表明氧疗目标的微小差异不太可能对患者预后产生有意义的影响 。
表 1 本综述中报告的随机对照试验的主要特征和结果
急性呼吸窘迫综合征
在急性呼吸窘迫综合征(ARDS)中,炎症和富含蛋白质的肺水肿会损害气体交换,而高FiO₂暴露会损伤气道黏膜和肺泡[5,9]。尽管高氧血症相对不常见[47],考虑到实现高氧血症的挑战,最佳的氧合目标仍不确定。ARDS网络对10项试验的纵向分析引入了累积高于目标氧暴露(计算为FiO₂超过0.5且PaO₂>80 mmHg的参与者)与不同严重程度ARDS患者临床结局恶化之间的剂量 - 反应关系的概念[28]。同样,Boyle等人[48]在202名前瞻性纳入的ARDS患者中发现,前7天平均时间加权PaO₂与死亡率之间存在U形关联。这些数据表明,累积氧剂量可能会影响急性肺损伤患者的临床结局。虽然Madotto等人[47]没有发现高氧血症与死亡风险之间的关系,但他们对LUNG SAFE研究中2005名ARDS患者的分析显示,30%的患者出现高氧血症(PaO₂>100 mmHg),尤其是轻度ARDS患者。在这些高氧血症患者中,三分之二的人暴露于FiO₂>0.6(例如过量的FiO₂给药)。然而,到第2天,中位FiO₂水平下降,不到一半的高氧血症患者持续存在高氧。值得注意的是,近80%的病例中过量的FiO₂给药是短暂的,这可能表明在通气支持后病情迅速改善。尽管如此,到第2天,每个FiO₂十分位数中仍约有三分之一的患者保持高氧血症,这凸显了进一步降低FiO₂和更个性化氧暴露的潜力。
急性中枢神经系统损伤
急性脑损伤患者补充氧气旨在增强组织氧输送并预防继发性脑损伤。然而,ROS的产生、脑兴奋性毒性、小胶质细胞激活和血管收缩引发了对高氧安全性及其与患者结局关系的质疑。
Rezoagli等人[49]报告称,在创伤性脑损伤(TBI)患者中,住院第一周的高氧暴露(通过FiO₂水平或PaO₂测量)与不良结局(如死亡率和6个月时GOSE评分≤4)之间存在独立关联。
同样,对观察性ENIO研究[50]的事后分析发现,TBI患者中PaO₂值高于156 mmHg与院内死亡概率增加相关。有趣的是,最近使用脑微透析的小型研究表明,高氧可降低TBI后脑乳酸水平和乳酸与丙酮酸的比率[51,52]。虽然对于TBI患者而言,特定的高PaO₂阈值是否安全仍不清楚,但欧洲重症监护医学学会指南目前建议,无论颅内压是否升高,均应将目标设定为正常氧合(PaO₂ 80 - 120 mmHg)[53]。
尽管临床前证据表明高氧在急性缺血性卒中中具有潜在益处,但临床研究缺乏氧气治疗对这些患者具有保护作用的可靠证据。卒中氧气研究[29]纳入了8003名患者,研究了补充氧气(平均最高SpO₂ 99.1%)的效果,发现与对照组(平均最高SpO₂ 98.3%)相比,在90天内通过改良Rankin量表评估的发病率或7天内的死亡率没有差异。此外,氧暴露的调节似乎会影响脊髓损伤的恢复。虽然脊髓损伤的原发性损伤通常是不可逆的,但继发性损伤是一个动态过程,涉及氧化应激、炎症和细胞凋亡。这些现象导致脊髓功能退化,并且似乎会因急性间歇性低氧暴露而加剧[54]。
心脏骤停和心肌梗死
心脏骤停期间,氧输送严重受损,大脑的氧供应也受到影响,导致几分钟内神经元死亡。目前,国际复苏联合委员会建议在心肺复苏期间使用最高剂量的氧气,以最大化大脑的氧输送[55],并建议在成人自主循环恢复(ROSC)后,在能够可靠测量SpO₂或PaO₂之前,持续使用100% FiO₂[56]。
心脏骤停后,缺血导致内皮激活,增加微血管对液体和蛋白质的通透性,并招募炎症白细胞[57]。再灌注后,激活的白细胞释放ROS,加剧炎症反应[58]。随后,局部炎症反应可激活全身性炎症综合征。在这种情况下,高氧会加剧ROS的产生,具有潜在的神经毒性作用,并增加再灌注脑损伤。在此阶段,如果能够可靠评估动脉血氧饱和度,临床医生建议将SpO₂水平维持在94% - 98%,或维持PaO₂在75 - 100 mmHg[55,59]。虽然这些建议证据级别较低且确定性差,但在过去十年中,我们对氧合如何影响ROSC后结局的理解迅速发展。心脏骤停后,氧补充不足或过量对患者生存的潜在风险日益明显[35,60]。心脏骤停后降低氧治疗(EXACT)试验评估了院外心脏骤停且在院前环境中已建立高级气道的成年患者的氧滴定情况[35]。在该试验中,ROSC稳定且在100% FiO₂下SpO₂>94%的患者被随机分为两个SpO₂目标组:90 - 94%和96 - 98%,直至在ICU进行首次动脉血气分析。较低SpO₂组的出院生存率(主要结局)较低(38.3%对47.9%;差异为 - 9.6% [95%置信区间(CI), - 18.9%至 - 0.2%];未调整优势比为0.68 [95% CI,0.46 - 1.00];P = 0.05)。随机分配到较低SpO₂组的患者在入住ICU前发生低氧血症(SpO₂<90%)的比例更高,并且需要将FiO₂提高到1的比例也更高(31%对16%,P<0.001),而两组之间的其他次要结局没有差异。尽管该研究因COVID - 19大流行而停止,但这些数据显示出在院前环境中较低SpO₂滴定可能存在危害。
在院内环境中,两项观察性研究表明,心脏骤停后24小时内的高氧血症与神经功能恢复受损和死亡率增加相关[61,62]。Roberts等人[61]发现,在280名院内心脏骤停和院外心脏骤停后的昏迷患者中,ROSC后PaO₂超过300 mmHg时,不良神经结局呈指数增加。值得注意的是,他们的队列中约40%的患者PaO₂超过了这一阈值。然而,在最大的一项比较心脏骤停后血压和氧合目标的随机试验(BOX试验)中,采用2×2析因设计,Schmidt等人[36]发现,限制性氧合目标(PaO₂ 68 - 75 mmHg)和自由氧合目标(PaO₂ 98 - 105 mmHg)在死亡率或任何次要终点方面没有差异。此外,COMACARE试验[32]比较了两个不同的PaO₂目标(PaO₂ 75 - 113 mmHg与PaO₂ 150 - 188 mmHg),发现院外心脏骤停后48小时,两组神经元特异性烯醇化酶的血清浓度没有差异。两组之间脑损伤新生物标志物神经丝轻链的水平也未观察到差异[34]。已经进行了几项III期临床试验的亚研究,以评估氧目标与结局之间的关联。在ICU - ROX试验[33]中随机分配的166名疑似缺氧缺血性脑病患者中,保守氧疗组(目标SpO₂<97%)在6个月时的死亡或不良神经结局发生率为55.1%(78名患者中有43名),而更自由的(SpO₂>90%)氧疗组为68.1%(72名患者中有49名)(优势比为0.58;95% CI为0.3 - 1.12;P = 0.1)。此外,保守组的无血管活性药物天数和无机械通气天数更多。在对HOT ICU试验中纳入的335名ROSC后心脏骤停患者的预先计划的亚分析中[38],低氧组和高氧组在3个月时的调整后死亡率差异为5.6%(95% CI为 - 4.88至16.05),1年时结果相似(调整后相对风险(RR)为1.05,95% CI为0.90 - 1.21,P = 0.53)。最后,对院外心脏骤停后目标体温管理2(TTM2)试验的事后分析探讨了低氧血症(PaO₂<60 mmHg)或高氧血症(PaO₂>300 mmHg)与6个月时死亡和神经功能障碍的关联[37]。作者表明,24.9%的患者至少发生一次低氧血症,7.6%的患者至少发生一次高氧血症,并且长时间暴露于高氧血症与死亡率显著相关(P = 0.003)。
在急性心肌梗死方面,欧洲心脏病学会目前的指南不建议对无低氧血症(SpO₂≥90%)的患者常规进行氧疗,仅建议对氧饱和度<90%的患者进行氧疗[63]。这些建议基于大型随机试验的证据,这些试验评估了疑似心肌梗死且基线时无低氧血症的患者补充氧气与吸入环境空气的效果[31,64]。确定氧气在疑似急性心肌梗死中的作用(DETO2X - AMI)试验[64]纳入了6629名患者,结果显示,与环境空气相比,补充氧气对1年全因死亡率或心肌梗死再住院发生率没有显著影响。Stub等人[30]证明,接受8 L/min氧气(中位SpO₂ 98%)的患者与接受4 L/min氧气(中位SpO₂ 100%)的患者相比,结局更差,包括急性心肌梗死复发率更高、心律失常、梗死面积更大和死亡率增加。然而,该研究纳入了救护车到达时已有ST段抬高型心肌梗死(STEMI)证据的患者,并且仅纳入了基线时SpO₂>94%的患者 。
脓毒症和脓毒性休克
关于高氧在脓毒症或脓毒性休克中的安全性证据相互矛盾。氧化应激在通过氧细胞增多作用清除细菌方面起着关键作用,氧合血红蛋白释放的氧气有助于杀死细菌。这些“抗菌”益处也在手术患者中得到证实,在围手术期暴露于较高氧水平(平均PaO₂ 286 mmHg)的手术患者手术伤口感染发生率降低[65]。
此外,一些证据表明,结局可能取决于氧暴露的时机。早期使用氧疗在调节脓毒性休克时对损伤的免疫反应方面显示出前景[66]。在盲肠结扎穿孔所致的多微生物感染小鼠模型中,剂量依赖性高压氧治疗(253.31 kPa的FiO₂ 1,每12小时一次)通过很大程度上独立于直接细菌毒性的机制提高了生存率[67]。相反,这些益处归因于白细胞介素 - 10水平升高(一种B细胞调节剂),并且据细菌载量分析推测,可能还与细菌播散减少有关。来自缺血/再灌注损伤引发的无菌性炎症模型的其他证据表明,高压氧治疗可以调节促炎级联反应。这是由于核因子 - κB、E - 选择素和细胞间黏附分子 - 1的下调,以及白细胞介素 - 6等促炎细胞因子水平的降低[68] 。此外,早期高氧通过改善组织氧合和引起全身血管收缩,在猪脓毒症模型的初始阶段对血流动力学稳定产生有益影响(在诱导腹膜炎后12、18和24小时,对照组和干预组的中位PaO₂水平分别为80 mmHg对490 mmHg、74 mmHg对337 mmHg和71 mmHg对286 mmHg)[68]。然而,一项对健康志愿者诱导脓毒症反应的生理学研究发现,对照组(峰值PaO₂ 125 mmHg)和高氧血症组(峰值PaO₂ 525 mmHg)在血流动力学或细胞因子水平上没有显著差异[69] 。
虽然高氧可能对全身器官有益、调节免疫反应并发挥杀菌作用,但它也会对肺部造成风险。因此,氧疗需要谨慎进行,以最大化益处并最小化对肺部的损害。关于脓毒症期间高氧有益作用的数据存在矛盾,主要源于高动力性休克的动物模型。HYPERS2S试验的事后分析表明,限制性氧疗可能具有潜在的生存益处,这与过度氧可能会加剧脓毒症特有的高ROS产生和线粒体功能障碍的假设一致[70] 。该理论认为,高氧暴露可能会使这些情况恶化。尽管如此,在这种情况下高氧的最佳应用尚未得到充分探索。
肿瘤血液病患者
随着肿瘤治疗的进步和患者预后的改善,过去几十年中入住ICU的肿瘤血液病患者数量有所增加,主要是因为脓毒性休克或肺炎。在这一患者群体中,细胞缺氧已知会促进癌细胞存活和血管生成[70],并且进一步研究发现它是一个预后因素和治疗靶点。然而,高氧(血症)也可能导致肺毒性并加剧肺损伤。在这些前提下,Dumas等人[71]在11249名入住ICU的血液系统恶性肿瘤合并急性呼吸衰竭的ICU患者队列中,发现日间PaO₂水平与28天死亡率之间存在显著的U形关系。在这些患者中,56%患有急性白血病,38%患有淋巴瘤或多发性骨髓瘤。ICU入院主要是因为ARDS(43%)、脓毒症(40%)、心脏骤停(5.5%)和神经系统疾病(7%)。值得注意的是,在使用FiO₂ 1.0进行通气的患者中,高氧血症非常普遍,并且在每个FiO₂十分位数中,约三分之一的患者存在高氧血症。在高氧血症患者中,定义为FiO₂≥0.6的过量氧使用在第一天观察到20%的患者(中位PaO₂ 163 mmHg),到第三天为10%的患者。尽管需要进一步研究来了解恶性肿瘤患者氧合水平与结局之间的生物学关系,但这些发现表明,调整临床实践可能会显著影响死亡率,并且可能不会带来临床危害。
重症监护病房出院患者的长期结局
重症监护从业者的临床关注点包括ICU入院后的长期残疾,通常称为重症监护后综合征(post-intensive care syndrome)[72]。这引发了对不同氧合目标是否可能影响长期结局的研究。ICU - ROX试验[23]是最早探索这一问题的研究之一,发现两组在6个月时的死亡率或认知障碍方面没有显著差异。然而,接受氧疗以目标SpO₂>97%的患者在欧洲五维健康量表5级版(EuroQoL - 5D - 5L)问卷中的个人护理和活动能力评分更好。
值得注意的是,该试验显示两组在无机械通气支持天数(已知的重症监护后综合征风险因素)方面没有差异。其他研究人员通过电话访谈进行了为期1年的随访,以调查长期结局的潜在差异。HOT - ICU试验[26]聚焦于因急性低氧性呼吸衰竭入住ICU的病因混杂的患者。参与者被随机分配接受氧疗,目标PaO₂为60或90 mmHg,直至随机化后90天。随后,HOT - ICU试验[27]和HOT - COVID试验[22]的事后分析检查了危重症COVID - 19患者在接受不同氧合目标(PaO₂ 60或90 mmHg)时的结局差异。尽管在短期结局方面未观察到显著的组间差异,但Nielsen的分析显示,低氧治疗组的无生命支持存活天数更多。Crescioli等人[73,74]进一步评估了这些研究队列中1年的健康相关生活质量。两项分析均表明,在1年的随访中,不同的氧合目标水平并未导致生存率或健康相关生活质量的改善。
慢性阻塞性肺疾病和哮喘急性加重
氧疗是慢性阻塞性肺疾病急性加重(AECOPD)的基础治疗手段。然而,在给氧时必须谨慎调整剂量,以避免过度吸氧带来的风险,尤其是对于有发生高碳酸血症(Ⅱ型)呼吸衰竭风险的患者。这类患者往往存在慢性高碳酸血症,过量吸氧会抑制低氧驱动,进而导致高碳酸血症加重、呼吸性酸中毒,甚至可能引发呼吸衰竭[75]。
在AECOPD患者中,英国胸科学会建议使用28%文丘里面罩,以4L/min的流速吸氧,使SpO₂维持在88% - 92%[76]。需在30 - 60分钟内检查动脉血气,评估是否存在高碳酸血症和酸中毒[77]。若动脉血气显示患者PaCO₂水平正常,可调整吸氧剂量,使SpO₂达到94% - 98%。若经过最佳氧疗后,高碳酸血症和酸中毒依然存在,则应启动无创通气以提供呼吸支持。
AECOPD患者过度吸氧的危害已得到充分证实。Echevarria等人[78]对1027名接受吸氧治疗的住院AECOPD患者进行研究,分析入院时氧饱和度水平对住院死亡率的影响。该研究将患者按氧饱和度水平分组(≤87%、88% - 92%、93% - 96%和97% - 100%)进行数据分析,结果显示,高于指南推荐范围(88% - 92%)的氧饱和度与死亡率显著上升相关。具体而言,与88% - 92%组相比,93% - 96%组的死亡调整优势比为1.98(95%置信区间1.09 - 3.60,P = 0.025),97% - 100%组为2.97(95%置信区间1.58 - 5.58,P = 0.001)。
对纳入HOT - ICU试验的536名患者进行的预先计划的二次分析,旨在探究较低的氧合目标(PaO₂ 60mmHg,SpO₂ 88% - 92%)是否比更高的目标(PaO₂ 90mmHg,SpO₂ 94% - 98%)能降低死亡率[128]。结果显示,两组患者90天死亡率并无统计学差异(相对风险:0.98,95%置信区间:0.82 - 1.17,P = 0.67)。而且,两组患者的PaCO₂水平都得到了严格控制,在包括ICU住院时长或再入院率等次要结局方面也未发现显著差异。这表明,若能密切监测PaCO₂水平,较低的PaO₂目标也可安全使用。氧疗是哮喘急性加重期的关键治疗措施。但有证据强调,滴定式给氧十分重要,可避免因过度吸氧引发并发症。2023年全球哮喘防治创议(Global Initiative for Asthma)更新内容强调,应将SpO₂维持在93% - 95%[79]。这种方法比无控制的高浓度氧疗效果更佳,尤其适用于有呼吸衰竭风险的患者。
多项比较不同给氧策略的研究都凸显了无控制给氧的风险。在一项针对74例急性重症哮喘患者的随机试验中,Rodrigo等人[41]发现,与接受FiO₂ 0.28的患者相比,FiO₂为1的患者PaCO₂水平显著升高(P = 0.03),呼气峰流速(PEFR)降低(P = 0.001),尤其是基线PaCO₂ > 40mmHg的患者。同样,Perrin等人[42]在106例严重哮喘发作患者中,对比了高浓度吸氧(8L/min)和滴定式吸氧(SpO₂ 93% - 95%),发现高浓度吸氧组发生高碳酸血症的风险显著更高,PaCO₂升高≥4mmHg(相对风险2.3,95%置信区间1.2 - 4.4,P < 0.006),且最终PaCO₂≥45mmHg的严重病例均出现在高浓度吸氧组,这进一步证实了较高吸氧浓度可能导致高碳酸血症性呼吸衰竭。Chien等人[80]也报告称,无控制的给氧会使哮喘患者高碳酸血症加重,46.7%的受试者在FiO₂为1的情况下,20分钟后出现高碳酸血症性呼吸衰竭。综上所述,这些数据有力地支持在哮喘急性发作时采用滴定式氧疗,以优化治疗效果。
新生儿和儿科重症监护
氧疗是新生儿护理中的关键干预措施,它既有显著益处,也存在风险。过度吸氧会导致氧化应激,这是新生儿多种疾病(如早产儿视网膜病变、支气管肺发育不良、脑室内出血和坏死性小肠结肠炎)的关键致病因素[81 - 83]。由于新生儿抗氧化系统不成熟,这些风险尤为突出[84]。
对于足月儿,研究表明使用空气(FiO₂ 0.21)进行复苏效果良好[45,85]。足月儿通常仅需通过空气进行正压通气,就能实现正常的心肺适应,且不会出现明显的氧化并发症。相比之下,早产儿,尤其是胎龄小于32周的早产儿,往往需要更高的FiO₂来维持生命体征稳定[86,87]。但这也增加了他们对氧化应激及相关疾病的易感性。Vento等人[44]进一步研究发现,与FiO₂ 0.9相比,使用FiO₂ 0.3对早产儿进行初始复苏,可降低氧化应激指标(P < 0.01),减少机械通气天数(13天对比27天,P < 0.01),降低支气管肺发育不良的发生率(15.4%对比31.7%,P < 0.05)。
NEOPROM荟萃分析[88]评估了极低出生体重儿(<28周)的氧饱和度目标的影响。结果显示,将氧饱和度目标设定在较低范围(85% - 89%),虽能降低严重早产儿视网膜病变的发生风险(相对风险0.74,95%置信区间0.59 - 0.92),但会显著增加死亡率(相对风险1.41,95%置信区间1.14 - 1.74)和坏死性小肠结肠炎的发生率(相对风险1.25,95%置信区间1.05 - 1.49)。
在接受体外膜肺氧合(ECMO)支持的呼吸衰竭新生儿中,ECMO启动后早期缺氧或中度高氧,都会增加28天死亡率的发生几率[89]。
总之,氧疗需根据新生儿的胎龄和临床状况进行精确调整。近期研究强调了氧疗管理对儿科ICU患者预后的重要影响。如一项队列研究和系统综述所示,Raman等人[90]发现,入住ICU的危重症患儿的PaO₂与死亡率之间存在U型关联。因此,在这一患者群体中,过低或过高的氧合水平都可能对预后产生不良影响。
Lilien等人[91]的系统综述指出,在一项纳入11项研究、共计23204名患者的荟萃分析中,高氧与死亡率相关,优势比为1.59(I² = 92%)。尽管有这些发现,但纳入研究对高氧的定义和评估方式各不相同,大多数研究将PaO₂作为氧暴露的主要变量。在一项观察性研究中,Ramgopal等人[92]报告称,严重高氧血症(定义为PaO₂大于300mmHg)与院内死亡率增加独立相关。他们的数据显示,院内死亡率与高氧暴露剂量呈正相关,暴露于一次、两次和三次及以上严重高氧血症事件后,调整后的优势比分别为1.47(95%置信区间1.05 - 2.08;P = 0.03)、2.01(95%置信区间1.27 - 3.18;P = 0.002)和2.53(95%置信区间1.62 - 3.94;P < 0.001)。同样,Numa等人[93]证实,PaO₂≥250mmHg的患者死亡调整优势比为2.66。在Oxy - PICU试验中,Peters等人[46]比较了保守(SpO₂ 88% - 92%)和自由(SpO₂>94%)两种氧合目标对主要结局的影响。结果表明,保守的氧合目标可略微缩短器官支持时间并降低死亡概率。然而,由于临床优先事项(如急性病情恶化或物理治疗)以及人员配备问题(包括对试验的认识不足),保守方案的依从性面临挑战。这些研究共同揭示了儿科ICU患者氧合水平与预后之间的复杂关系。
针对合适患者进行氧暴露管理:人群富集策略
危重症病情复杂且具有异质性,通过平均结局差异评估治疗效果在这种情况下可能并不有效。关注 “平均情况” 会使临床医生忽视每个患者的独特性。在重症监护中,通常会对一系列临床综合征(如ARDS、脓毒性休克和心源性休克)进行治疗。然而,临床医生意识到,这些综合征中的每一种都包含多种临床表现,甚至连指南都无法涵盖所有可能的 “亚表型”。传统上,在进行随机对照试验(RCT)后,首要的研究工作是进行事后亚组分析,但由于研究本身的局限性,这种分析往往无法提供可靠的见解。此外,患者的多种内在特征,包括临床表现和人口统计学特征,都可能对治疗结果产生不可预测的影响。
人群富集旨在识别更有可能对干预措施产生反应的患者亚表型,从而克服试验局限性,提高因果推断的效率。在具有相同临床状况的患者队列中区分亚表型,有助于更深入地了解特定治疗对结局的影响,并推动精准医疗的实施[94]。预测建模的新工具,如机器学习,能够整合预后、临床和生化数据,以促进人群富集[95]。
Buell等人[96]的出色研究表明,“一刀切” 的方法并不适用,并提出了一种创新方法,利用人工智能的潜力,切实推进人群富集策略。作者开发了一种机器学习模型,用于预测PILOT试验(作为衍生队列)中较低和较高SpO₂目标对患者死亡率的影响。该模型能够预测不同患者特征与不同氧合目标之间的复杂相互作用。最终,他们识别出了能从不同SpO₂目标中获益的患者群体。例如,预测老年男性且急性脑损伤患病率较高的患者可能从较低的SpO₂目标中获益;而脓毒症、呼吸系统疾病患病率较高且生命体征严重异常的患者,可能从较高的SpO₂目标中获益。该模型使用ICU - ROX试验中的患者数据进行了验证,验证队列的结果有力地证实了在衍生队列中获得的结果。研究人员估计,在ICU - ROX试验中应用他们的机器学习模型,可使总体死亡率绝对降低6.4%。不过,这一结果仍需前瞻性验证。
未来方向——为合适的患者提供合适的氧剂量
呼吁个性化氧疗策略
近期关于人群富集策略的研究结果强调,推进个性化氧合目标指南的制定是未来的明智方向。深入研究氧中毒的病理生理机制,结合表型分析和人工智能领域的创新成果,将有助于更精确地对目标人群亚组进行分层。未来的研究可借助先进的人群富集工具,对重症监护中的氧补充和组织氧暴露进行更细致的阐释。
虽然预防组织缺氧至关重要,但过度氧合(高氧)会带来重大风险,尤其是对肺组织。应仅在特定情况下使用高氧,这些情况需能使全身器官受益或发挥杀菌作用。目前的指南主要将氧目标定义为适用于广泛人群的安全措施,缺乏个性化。此外,氧过量补充的情况仍然普遍,常常超出生理需求和既定推荐标准。在优化氧输送(DO₂)后,避免不必要的氧暴露,可能会改善患者的预后。在临床实践中,密切监测PaO₂和SpO₂,对于防止危重症患者暴露于不必要且可能有害的高氧血症至关重要。
氧目标、氧监测与危重症患者的长期结局
初期研究应着重规范高氧血症的定义和检测方法。文献中氧合目标的差异,给监测工作带来困难,也使患者更易暴露于高氧血症中。新的研究还应关注尚未充分探索的氧生理指标,如DO₂、组织氧合和微血管功能,这些指标能提供有价值的生理学信息。此外,近期研究开始重视评估不同氧合目标与长期结局之间的关系。对ICU出院患者进行随访评估的研究,已就氧暴露与长期结局之间的联系提供了有价值的见解,为未来研究奠定了基础。
由于这是一篇受邀撰写的叙述性综述,并未系统涵盖该主题的所有文献。然而,根据作者对相关文献的批判性回顾和观点,我们强调了研究方法中存在的显著差距,并指出有必要改进研究方法,以实现重症监护中氧疗的个性化。对当前实践和未来策略进行批判性评估,对于解决这一临床相关主题的复杂性、推进真正的精准医疗目标至关重要。
作者贡献
CR和ER构思并撰写了初稿,构思并绘制了原始图表和表格。所有作者对论文的重要知识内容进行了审阅和编辑。所有作者阅读、讨论并批准了最终发表的稿件。
利益冲突
无申报。
数据可用性声明
不适用。
开放获取声明
这是一本开放获取期刊,文章根据知识共享署名 - 非商业性使用 - 相同方式共享4.0许可协议分发,允许他人在非商业的前提下对作品进行重新混合、调整和构建,只要适当引用并按照相同的许可协议发布新的创作内容。
参考文献
1. Rich P. Chemiosmotic coupling: The cost of living. Nature. 2003;421:583.
2. Pogge von Strandmann PA, Stüeken EE, ElliottT, et al. Selenium isotope evidence for progressive oxidation of the Neoproterozoic biosphere. Nat Commun. 2015;6:10157.
3. Martin D, de Jong A, Radermacher P. Is the U-shaped curve still of relevance to oxygenation of critically ill patients? Intensive Care Med. 2023;49:566 - 568.
4. Helmerhorst HJ, Arts DL, Schultz MJ, et al. Metrics of arterial hyperoxia and associated outcomes in critical care. Crit Care Med. 2017;45:187 - 195.
5. Singer M, Young PJ, Laffey JG, et al. Dangers of hyperoxia. Crit Care. 2021;25:440.
6. Sjöberg F, Singer M. The medical use of oxygen: a time for critical reappraisal. J Intern Med. 2013;274:505 - 528.
7. Collins JA, Rudenski A, Gibson J, Howard L, O’Driscoll R. Relating oxygen partial pressure, saturation and content: the haemoglobin - oxygen dissociation curve. Breathe (Sheff). 2015;11:194 - 201.
8. Siemieniuk RAC, Chu DK, Kim LH, et al. Oxygen therapy for acutely ill medical patients: a clinical practice guideline. BMJ. 2018;363:k4169.
9. Kallet RH, Matthay MA. Hyperoxic acute lung injury. Respir Care. 2013;58:123 - 141.
10. Davis WB, Rennard SI, Bitterman PB, Crystal RG. Pulmonary oxygen toxicity. Early reversible changes in human alveolar structures induced by hyperoxia. N Engl J Med. 1983;309:878 - 883.
11. Nash G, Blennerhassett JB, Pontoppidan H. Pulmonary lesions associated with oxygen therapy and artificial ventilation. N Engl J Med. 1967;276:368 - 374.
12. Aboab J, Jonson B, Kouatchet A, Taille S, Niklason L, Brochard L. Effect of inspired oxygen fraction on alveolar derecruitment in acute respiratory distress syndrome. Intensive Care Med. 2006;32:1979 - 1986.
13. Rezoagli E, Laffey JG, Bellani G. Monitoring lung injury severity and ventilation intensity during mechanical ventilation. Semin Respir Crit Care Med. 2022;43:346 - 368.
14. Ferrari M, Jain IH, Goldberger O, et al. Hypoxia treatment reverses neurodegenerative disease in a mouse model of Leigh syndrome. Proc Natl Acad Sci U S A. 2017;114:E4241 - E4250.
15. Pizzino G, Irrera N, Cucinotta M, et al. Oxidative stress: harms and benefits for human health. Oxid Med Cell Longev. 2017;2017:8416763.
16. Berra L, Medeiros KJ, Marrazzo F, et al. Feasibility of delivering 5 - day normobaric hypoxia breathing in a hospital setting. Respir Care. 2024;69:1400 - 1408.
17. Buell KG, Semler MW, Churpek MM. Individualized treatment in critical care: the oxygenation paradigm. Intensive Care Med. 2024;50:1327 - 1330.
18. Athale J, Suffredini AF. Pulse oximetry: a necessary imperfect tool in critical care. Crit Care Med. 2023;51:1246 - 1248.
19. de Jonge E, Peelen L, Keijzers PJ, et al. Association between administered oxygen, arterial partial oxygen pressure and mortality in mechanically ventilated intensive care unit patients. Crit Care. 2008;12:R156.
20. Girardis M, Busani S, Damiani E, et al. Effect of conservative vs conventional oxygen therapy on mortality among patients in an intensive care unit: the oxygen - icu randomized clinical trial. JAMA. 2016;316:1583 - 1589.
21. Chu DK, Kim LH, Young PJ, et al. Mortality and morbidity in acutely ill adults treated with liberal versus conservative oxygen therapy (IOTA): a systematic review and meta - analysis. Lancet. 2018;391:1693 - 1705.
22. Nielsen FM, Klitgaard TL, Siegemund M, et al. Lower vs higher oxygenation target and days alive without life support in COVID - 19: the HOT - COVID randomized clinical trial. JAMA. 2024;331:1185 - 1194.
23. ICU - ROX Investigators and the Australian and New Zealand Intensive Care Society Clinical Trials Group, Mackle D, Bellomo R, et al. Conservative oxygen therapy during mechanical ventilation in the ICU. N Engl J Med. 2020;382:989 - 998.
24. Gelissen H, de Grooth HJ, Smulders Y, et al. Effect of low - normal vs high - normal oxygenation targets on organ dysfunction in critically ill patients: a randomized clinical trial. JAMA. 2021;326:940 - 948.
25. Semler MW, Casey JD, Lloyd BD, et al. Oxygen - saturation targets for critically ill adults receiving mechanical ventilation. N Engl J Med. 2022;387:1759 - 1769.
26. Schjørring OL, Klitgaard TL, Perner A, et al. Lower or higher oxygenation targets for acute hypoxemic respiratory failure. N Engl J Med. 2021;384:1301 - 1311.
27. Rasmussen BS, Klitgaard TL, Perner A, et al. Oxygenation targets in ICU patients with COVID - 19: A post hoc subgroup analysis of the HOT - ICU trial. Acta Anaesthesiol Scand. 2022;66:76 - 84.
28. Aggarwal NR, Brower RG, Hager DN, et al. Oxygen exposure resulting in arterial oxygen tensions above the protocol goal was associated with worse clinical outcomes in acute respiratory distress syndrome. Crit Care Med. 2018;46:517 - 524.
29. Roffe C, Nevatte T, Sim J, et al. Effect of routine low - dose oxygen supplementation on death and disability in adults with acute stroke: the stroke oxygen study randomized clinical trial. JAMA. 2017;318:1125 - 1135.
30. Stub D, Smith K, Bernard S, et al. Air versus oxygen in ST - segment - elevation myocardial infarction. Circulation. 2015;131:2143 - 2150.
31. Hofmann R, James SK, Jernberg T, et al. Oxygen therapy in suspected acute myocardial infarction. N Engl J Med. 2017;377:1240 - 1249.
32. Jakkula P, Reinikainen M, Hästbacka J, et al. Targeting two different levels of both arterial carbon dioxide and arterial oxygen after cardiac arrest and resuscitation: a randomised pilot trial. Intensive Care Med. 2018;44:2112 - 2121.
33. Young P, Mackle D, Bellomo R, et al. Conservative oxygen therapy for mechanically ventilated adults with suspected hypoxic ischaemic encephalopathy. Intensive Care Med. 2020;46:2411 - 2422.
34. Wihersaari L, Ashton NJ, Reinikainen M, et al. Neurofilament light as an outcome predictor after cardiac arrest: a post hoc analysis of the COMACARE trial. Intensive Care Med. 2021;47:39 - 48.
35. Bernard SA, Bray JE, Smith K, et al. Effect of lower vs higher oxygen saturation targets on survival to hospital discharge among patients resuscitated after out - of - hospital cardiac arrest: the EXACT randomized clinical trial. JAMA. 2022;328:1818 - 1826.
36. Schmidt H, Kjaergaard J, Hassager C, et al. Oxygen targets in comatose survivors of cardiac arrest. N Engl J Med. 2022;387:1467 - 1476.
37. Robba C, Badenes R, Battaglini D, et al. Oxygen targets and 6 - month outcome after out of hospital cardiac arrest: a pre - planned sub - analysis of the targeted hypothermia versus targeted normothermia after Out - of - Hospital Cardiac Arrest (TTM2) trial. Crit Care. 2022;26:323.
38. Crescioli E, Lass Klitgaard T, Perner A, Lilleholt Schjørring O, Steen Rasmussen B. Lower versus higher oxygenation targets in hypoxaemic ICU patients after cardiac arrest. Resuscitation. 2023;188:109838.
39. Asfar P, Schortgen F, Boisramé - Helms J, et al. Hyperoxia and hypertonic saline in patients with septic shock (HYPERS2S): a two - by - two factorial, multicentre, randomised, clinical trial. Lancet Respir Med. 2017;5:180 - 190.
40. Demiselle J, Wepler M, Hartmann C, et al. Hyperoxia toxicity in septic shock patients according to the Sepsis - 3 criteria: a post hoc analysis of the HYPER2S trial. Ann Intensive Care. 2018;8:90.
41. Rodrigo GJ, Rodriquez Verde M, Peregalli V, Rodrigo C. Effects of short - term 28% and 100% oxygen on PaCO2 and peak expiratory flow rate in acute asthma: a randomized trial. Chest. 2003;124:1312 - 1317.
42. Perrin K, Wijesinghe M, Healy B, et al. Randomised controlled trial of high concentration versus titrated oxygen therapy in severe exacerbations of asthma. Thorax. 2011;66:937 - 941.
43. Nielsen MB, Klitgaard TL, Weinreich UM, et al. Effects of a lower versus a higher oxygenation target in intensive care unit patients with chronic obstructive pulmonary disease and acute hypoxaemic respiratory failure: a subgroup analysis of a randomised clinical trial. BJA Open. 2024;10:100281.
44. Vento M, Moro M, Escrig R, et al. Preterm resuscitation with low oxygen causes less oxidative stress, inflammation, and chronic lung disease. Pediatrics. 2009;124:e439 - 449.
45. Tataranno ML, Oei JL, Perrone S, et al. Resuscitating preterm infants with 100% oxygen is associated with higher oxidative stress than room air. Acta Paediatr. 2015;104:759 - 765.
46. Peters MJ, Gould DW, Ray S, et al. Conservative versus liberal oxygenation targets in critically ill children (Oxy - PICU): a UK multicentre, open, parallel - group, randomised clinical trial. Lancet. 2024;403:355 - 364.
47. Madotto F, Rezoagli E, Pham T, et al. Hyperoxemia and excess oxygen use in early acute respiratory distress syndrome: insights from the LUNG SAFE study. Crit Care. 2020;24:125.
48. Boyle AJ, Holmes DN, Hackett J, et al. Hyperoxaemia and hypoxaemia are associated with harm in patients with ARDS. BMC Pulm Med. 2021;21:285.
49. Rezoagli E, Petrosino M, Rebora P, et al. High arterial oxygen levels and supplemental oxygen administration in traumatic brain injury: insights from CENTER - TBI and OzENTER - TBI. Intensive Care Med. 2022;48:1709 - 1725.
50. Robba C, Battaglini D, Cinotti R, et al. Individualized thresholds of hypoxemia and hyperoxemia and their effect on outcome in acute brain injured patients: a secondary analysis of the ENIO study. Neurocrit Care. 2024;40:515 - 528.
51. Giannì G, Minini A, Fratino S, et al. The impact of short - term hyperoxia on cerebral metabolism: a systematic review and meta - analysis. Neurocrit Care. 2022;37:547 - 557.
52. Ghosh A, Highton D, Kolyva C, Tachtsidis I, Elwell CE, Smith M. Hyperoxia results in increased aerobic metabolism following acute brain injury. J Cereb Blood Flow Metab. 2017;37:2910 - 2920.
53. Robba C, Poole D, McNett M, et al. Mechanical ventilation in patients with acute brain injury: recommendations of the European Society of Intensive Care Medicine consensus. Intensive Care Med. 2020;46:2397 - 2410.
54. Pearcey GEP, Afsharipour B, Holobar A, Sandhu MS, Rymer WZ. Acute intermittent hypoxia increases maximal motor unit discharge rates in people with chronic incomplete spinal cord injury. J Physiol. 2024;602:5699 - 5711.
55. Greif R, Bray JE, Djärv T, et al. 2024 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations: Summary From the Basic Life Support; Advanced Life Support; Pediatric Life Support; Neonatal Life Support; Education, Implementation, and Teams; and First Aid Task Forces. Resuscitation. 2024;205:110414.
56. Soar J, Berg KM, Andersen LW, et al. Adult advanced life support: 2020 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Resuscitation. 2020;156:A80 - A119.
57. Bro - Jeppesen J, Johansson PI, Hassager C, et al. Endothelial activation/injury and associations with severity of post - cardiac arrest syndrome and mortality after out - of - hospital cardiac arrest. Resuscitation. 2016;107:71 - 79.
58. Adrie C, Laurent I, Monchi M, Cariou A, Dhainaou JF, Spaulding C. Postresuscitation disease after cardiac arrest: a sepsis - like syndrome? Curr Opin Crit Care. 2004;10:208 - 212.
59. Nolan JP, Sandroni C, Böttiger BW, et al. European Resuscitation Council and European Society of Intensive Care Medicine guidelines 2021: postresuscitation care. Intensive Care Med. 2021;47:369 - 421.
60. Awad A, Nordberg P, Jonsson M, et al. Hyperoxemia after reperfusion in cardiac arrest patients: a potential dose - response association with 30 - day survival. Crit Care. 2023;27:86.
61. Roberts BW, Kilgannon JH, Hunter BR, et al. Association between early hyperoxia exposure after resuscitation from cardiac arrest and neurological disability: prospective multicenter protocol - directed cohort study. Circulation. 2018;137:2114 - 2124.
62. Kilgannon JH, Jones AE, Shapiro NI, et al. Association between arterial hyperoxia following resuscitation from cardiac arrest and in - hospital mortality. JAMA. 2010;303:2165 - 2171.
63. Collet JP, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST - segment elevation. Eur Heart J. 2021;42:1289 - 1367.
64. Hofmann R, James SK, Svensson L, et al. DETermination of the role of OXygen in suspected acute myocardial infarction trial. Am Heart J. 2014;167:322 - 328.
65. Belda FJ, Aguilera L, García de la Asunción J, et al. Supplemental perioperative oxygen and the risk of surgical wound infection: a randomized controlled trial. JAMA. 2005;294:2035 - 2042.
66. Calzia E, Asfar P, Hauser B, et al. Hyperoxia may be beneficial. Crit Care Med. 2010;38:S559 - 568.
67. Buras JA, Holt D, Orlow D, BelikoffB, Pavlides S, Reenstra WR. Hyperbaric oxygen protects from sepsis mortality via an interleukin - 10 - dependent mechanism. Crit Care Med. 2006;34:2624 - 2629.
68. Barth E, Bassi G, Maybauer DM, et al. Effects of ventilation with 100% oxygen during early hyperdynamic porcine fecal peritonitis. Crit Care Med. 2008;36:495 - 503.
69. Kiers D, Gerretsen J, Janssen E, et al. Short - term hyperoxia does not exert immunologic effects during experimental murine and human endotoxemia. Sci Rep. 2015;5:17441.
70. Wilson WR, Hay MP. Targeting hypoxia in cancer therapy. Nat Rev Cancer. 2011;11:393 - 410.
71. Dumas G, Morris IS, Hensman T, et al. Association between arterial oxygen and mortality across critically ill patients with hematologic malignancies: results from an international collaborative network. Intensive Care Med. 2024;50:697 - 711.
72. Hiser SL, Fatima A, Ali M, Needham DM. Post - intensive care syndrome (PICS): recent updates. J Intensive Care. 2023;11:23.
73. Crescioli E, Klitgaard TL, Poulsen LM, et al. Long - term mortality and health - related quality of life of lower versus higher oxygenation targets in ICU patients with severe hypoxaemia. Intensive Care Med. 2022;48:714 - 722.
74. Crescioli E, Riis J, Weinreich UM, et al. Long - term cognitive and pulmonary functions following a lower versus a higher oxygenation target in the HOT - ICU and HOT - COVID trials: a protocol update. Acta Anaesthesiol Scand. 2024;68:575 - 578.
75. Abdo WF, Heunks LM. Oxygen - induced hypercapnia in COPD: myths and facts. Crit Care. 2012;16:323.
76. O’Driscoll BR, Howard LS, Davison AG, British Thoracic Society. BTS guideline for emergency oxygen use in adult patients. Thorax. 2008;63 Suppl 6:vi1 - 68.
77. Kane B, Decalmer S, Ronan O’Driscoll B. Emergency oxygen therapy: from guideline to implementation. Breathe. 2013;9:246 - 253.
78. Echevarria C, Steer J, Wason J, Bourke S. Oxygen therapy and inpatient mortality in COPD exacerbation. Emerg Med J. 2021;38:170 - 177.
79. Asthma GIf. 2023 GINA report, global strategy for asthma management and prevention. https://ginasthma.org/2023 - gina - main - report/. Accessed December 6, 2024.
80. Chien JW, Ciufo R, Novak R, et al. Uncontrolled oxygen administration and respiratory failure in acute asthma. Chest. 2000;117:728-733.
81. Torres-Cuevas I, Parra-Llorca A, Sánchez-Illana A, et al. Oxygen and oxidative stress in the perinatal period. Redox Biol. 2017;12:674 - 681.
82. Saugstad OD. Oxygen and retinopathy of prematurity. J Perinatol. 2006;26 Suppl 1:S46 - 50; discussion S63 - 64.
83. Darlow BA, Morley CJ. Oxygen saturation targeting and bronchopulmonary dysplasia. Clin Perinatol. 2015;42:807 - 823.
84. Saugstad OD, Sejersted Y, Solberg R, Wollen EJ, Bjørås M. Oxygenation of the newborn: a molecular approach. Neonatology. 2012;101:315 - 325.
85. Saugstad OD, Ramji S, Soll RF, Vento M. Resuscitation of newborn infants with 21% or 100% oxygen: an updated systematic review and meta - analysis. Neonatology. 2008;94:176 - 182.
86. Madar J, Roehr CC, Ainsworth S, et al. European Resuscitation Council Guidelines 2021: Newborn resuscitation and support of transition of infants at birth. Resuscitation. 2021;161:291 - 326.
87. Aziz K, Lee HC, Escobedo MB, et al. Part 5: Neonatal Resuscitation: 2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Circulation. 2020;142:S524 - S550.
88. Saugstad OD, Aune D. Optimal oxygenation of extremely low birth weight infants: a meta - analysis and systematic review of the oxygen saturation target studies. Neonatology. 2014;105:55 - 63.
89. Brohan O, Chenouard A, Gaultier A, et al. Pa o2 and mortality in neonatal extracorporeal membrane oxygenation: retrospective analysis of the extracorporeal life support organization registry, 2015 - 2020. Pediatr Crit Care Med. 2024;25:591 - 598.
90. Raman S, Prince NJ, Hoskote A, Ray S, Peters MJ. Admission PaO2 and Mortality in Critically Ill Children: A Cohort Study and Systematic Review. Pediatr Crit Care Med. 2016;17:e444 - e450.
91. Lilien TA, Groeneveld NS, van Etten - Jamaludin F, et al. Association of arterial hyperoxia with outcomes in critically ill children: a systematic review and meta - analysis. JAMA Netw Open. 2022;5:e2142105.
92. Ramgopal S, Dezfulian C, Hickey RW, et al. Association of severe hyperoxemia events and mortality among patients admitted to a pediatric intensive care unit. JAMA Netw Open. 2019;2:e199812.
93. Numa A, Aneja H, Awad J, et al. Admission hyperoxia is a risk factor for mortality in pediatric intensive care. Pediatr Crit Care Med. 2018;19:699 - 704.
94. Gordon AC, Alipanah - Lechner N, Bos LD, et al. From ICU syndromes to ICU subphenotypes: consensus report and recommendations for developing precision medicine in the ICU. Am J Respir Crit Care Med. 2024;210:155 - 166.
95. Graham Linck EJ, Goligher EC, Semler MW, Churpek MM. Toward precision in critical care research: methods for observational and interventional studies. Crit Care Med. 2024;52:1439 - 1450.
96. Buell KG, Spicer AB, Casey JD, et al. Individualized treatment effects of oxygen targets in mechanically ventilated critically ill adults. JAMA. 2024;331:1195 - 1204.
原文链接:Medical Gas Research
https://wap.sciencenet.cn/blog-3430044-1484487.html
下一篇:老年脓毒性休克患者靶向高平均动脉压的疗效(OPTPRESS):一项多中心、实用性、开放标签随机对照试验