博文
一种潜在治疗镰刀贫血病的表观遗传调节药物  精选
精选
|
去年,美国食品和药物管理局(FDA)批准了两种基因疗法程序,这些程序可以治疗甚至在某些情况下基本治愈镰状细胞病,这是一种遗传性血液疾病,每年导致全球近375,000人死亡,给数百万人带来疼痛和贫血。但是,这些开创性的治疗需要冒险的化疗,并且每人的费用约为200万美元,这使得绝大多数镰状细胞病患者无法负担。现在,制药研究人员报告了一种潜在的口服药物,在疾病的动物模型中恢复了健康的血细胞。
与一次性的基因疗法不同,其益处可能持续数十年,这种新化合物可能需要终身定期服用,而且甚至还没有开始在人类中进行安全性测试。但是,今天在《科学》杂志上描述的实验药物为有一天能够广泛而廉价地用简单药丸治疗镰状细胞病提供了希望。
“这看起来很有希望,”未参与这项新研究的芝加哥伊利诺伊大学儿科血液学家刘易斯·徐说。然而,他警告说,“有一系列在小鼠和细胞中起作用的镰状细胞病[药物]治疗方法在人体中没有奏效。”
镰状细胞病是由负责制造成人血红蛋白的基因突变引起的。这种变化导致通常呈盘状的红细胞变成特有的月牙形状,并粘在一起,堵塞毛细血管,损害组织并引发剧烈疼痛发作。两种新批准的治疗方法之一使用一种工程病毒将修改后的成人血红蛋白基因副本插入患者自身的干细胞中。然后在化疗清除现有血液干细胞后,将这些编程细胞返回给患者。
另一种批准的治疗方法也修改了患者的血液干细胞,但使用了CRISPR基因编辑系统来阻止一种名为BCL11A的蛋白质的基因,这种蛋白质在成年人中抑制胎儿使用的血红蛋白的生产。在婴儿期,这种胎儿血红蛋白通常会随着婴儿转向生产成人版本而减少。因此,当CRISPR关闭BCL11A的基因时,它在血液干细胞中恢复了胎儿血红蛋白的产生,帮助镰状细胞病患者。
但是,基因疗法的高成本和复杂性使得很难看到这两种方法如何在低收入国家,特别是非洲大多数镰状细胞病患者居住的地方发挥作用。“遗憾的是,这种疗法将无法惠及许多患者,”生物制药公司安进的镰状细胞病专家杰伊·布拉德纳说。
制药公司长期以来一直在寻找药物以在成人中激活胎儿血红蛋白。1998年,FDA批准了一种名为羟基脲的药物,发现它可以适度增加胎儿血红蛋白的产生。但是,这种药物也可以抑制骨髓干细胞的增殖,引起贫血和其他副作用,这个问题也颠覆了其他几种潜在的镰状细胞药物。“整个领域都在与此挣扎,”诺华公司的血液学研究员帕梅拉·廷说。
由廷和布拉德纳领导的一个团队最近一直在寻找能够与一种称为cereblon的蛋白质结合的化合物,这种蛋白质已知会标记其他蛋白质以便通过细胞的自然蛋白质回收系统销毁。他们最初的希望是能找到一种帮助cereblon标记BCL11A蛋白质的化合物,从而恢复胎儿血红蛋白的产生。他们筛选了一个包含2814种cereblon结合分子的库,并将这些分子喂给未成熟的红细胞,发现了一种名为dWIZ-1的化合物,增加了胎儿血红蛋白的产生。
但它出乎意料地没有针对BCL11A,而是附着在另一个称为WIZ的基因调节蛋白上,这个蛋白以前不知道涉及控制胎儿血红蛋白水平。对该化合物的进一步改良产生了dWIZ-2,该团队发现它使红细胞中的胎儿血红蛋白产量从基线的17%增加到45%。布拉德纳说,后者的水平如果转化为人类,将产生功能性红细胞。该化合物还在口服给小鼠和两只恒河猴中的三只时有效,而且没有明显的副作用,团队报告说。“这是第一个诱导胎儿血红蛋白而不损害干细胞的小分子,”布拉德纳说。
尽管有这个承诺,该化合物仍然面临挑战。首先,WIZ在红细胞之外的许多细胞类型中制造,并且似乎在调节众多基因的活动中起作用。“这可能使其成为一个过于广泛的行动者”,无法安全地抑制,哈佛大学Dana-Farber癌症研究所的干细胞生物学家、资深镰状细胞病研究员斯图尔特·奥金说,他没有参与这项新工作。
但布拉德纳指出,dWIZ-2似乎在提升胎儿血红蛋白方面具有巨大的效果。因此,无论诺华的实验化合物是否通过临床试验,它已经帮助揭示了一种新颖的方式来控制红细胞产生的血红蛋白类型。布拉德纳建议,这本身可能为改进的镰状细胞药物铺平了道路。
红细胞中的色素血红蛋白(Hb)是一种四聚体蛋白,在胎儿期由两个α-和两个γ-珠蛋白链组成[胎儿血红蛋白(HbF):α2γ2],在出生后期由两个α-和两个β-珠蛋白链组成[成人血红蛋白(HbA):α2β2]。镰状细胞病(SCD)是一种影响全球数百万人的遗传性血液疾病,由成人β-珠蛋白基因中的一个点突变引起,该突变改变了一个氨基酸(Val6→Glu)。在这一期的第91页上,Ting等人(1)报告了一项依赖cereblon(CRBN)的蛋白质降解物的筛选,他们发现了一种可以降解广泛间隔锌指(WIZ)转录因子的小分子。在小鼠和猴子中的临床前研究表明,优化后的分子dWIZ-2能够降解WIZ并通过表观遗传机制大幅增加HbF的表达。这揭示了开发用于SCD的口服药物的一个有希望的方向。
在纯合子中,SCD突变导致镰状细胞血红蛋白(HbS)在低氧条件下聚合,进而使红细胞呈现出僵硬的、镰刀形状,而不是正常红细胞的灵活的、双凹盘状。正常的红细胞甚至可以穿过最小的血管,而镰状细胞则会卡在毛细血管中,这会引起炎症、氧化应激、凝血途径的激活以及一氧化氮代谢的改变。镰状化还会间歇性和不可预测地切断许多不同组织的血液供应——所谓的血管闭塞性发作——造成疼痛和慢性损伤。尽管许多疗法针对这些次要效应,但理想的治愈疗法应该通过减少HbS的聚合来针对主要异常。
最初在1948年,儿科医生Janet Watson的观察凸显了减少HbS聚合的最有效方式,她注意到后来发展成SCD的婴儿在新生儿时期几乎没有镰状化的红细胞或临床问题。她将此归因于生命早期存在的高水平HbF,并提议这可以阻止HbS的聚合(2)。1960年代和1970年代的家庭研究显示,少数患有遗传性持续胎儿血红蛋白(HPFH)和SCD的个体通常没有所有并发症和症状(3)。
在血红蛋白(HB)位点内,编码γ-珠蛋白的胎儿基因(HBG1和HBG2)和编码β-珠蛋白的成人基因(HBB)受到一组增强子的调控,称为位点控制区域(LCR)(4)。在胎儿期,LCR主要与HBG1和HBG2基因相互作用,在成人期与HBB相互作用,上调其表达,最终使每个红细胞充满超过2.5亿个HbA(α2β2)分子。在成人中,HBG1和HBG2启动子变得沉默,主要是通过转录因子B细胞淋巴瘤/白血病11A(BCL11A)。BCL11A在成人红系细胞中通过其自身的红系特异性增强子被激活(5, 6)。与另一个转录因子,白血病/淋巴瘤相关因子(LRF)(7)一起,这通常会抑制HBG1和HBG2的表达。因此,关闭成人红系细胞中的BCL11A从而提高HbF的表达水平。几项最近的临床试验使用基因和碱基编辑技术下调BCL11A表达或干扰HBG1和HBG2启动子中的BCL11A或LRF结合位点,已显示出可以提高HbF水平以大幅改善甚至可能治愈SCD患者的可能性(8)。然而,这样的治疗估计每位患者需要花费约200万美元,这使得这些方法无法成为治疗数百万受影响个体的可行方式。
增加镰状细胞病中的胎儿血红蛋白表达
缓解镰状细胞病(SCD)的主要目标是防止或逆转从胎儿血红蛋白(α2γ2)到成人血红蛋白(γ2βs2)的转变。抑制γ-珠蛋白基因(HBG1和HBG2)的主要途径涉及转录因子BCL11A和白血病/淋巴瘤相关因子(LRF;未显示)。一种针对性的治疗策略是改造BCL11A增强子以防止BCL11A表达。包括广泛间隔锌指(WIZ)在内的表观遗传修饰剂也可能作用于BCL11A途径和/或其他途径以抑制γ-珠蛋白基因的表达。诸如dWIZ-2之类的表观遗传修饰剂可能恢复γ-珠蛋白基因的表达以缓解血管闭塞性发作,但它们也可能导致脱靶效应。
一种替代方法是开发一种可以增加HbF表达的口服药物。1998年,羟基脲成为第一个被批准用于治疗SCD的口服药物。羟基脲导致HbF水平的变化和适度增加,并减少了SCD患者所见的许多血管并发症,延长了他们的期望寿命。然而,它的作用机制仍然不清楚。许多其他针对表观遗传修饰剂的口服药物(例如,组蛋白去乙酰化酶、组蛋白去甲基化酶和DNA甲基化的抑制剂)已在临床前研究中显示能激活HbF的产生(9)。然而,由于它们无法将HbF增加到临床有效水平或具有不可接受的脱靶效应,没有一种成功进入临床应用。
在他们的筛选中,Ting等人鉴定了一种分子胶降解物(dWIZ-1),他们发现它针对WIZ。随后的优化发现了一种药代动力学特性改善的化学类似物,称为dWIZ-2。他们展示了dWIZ-2在体外人类红系细胞中显著增加了HbF的表达,治疗后显示出正常的成熟过程。他们还观察到在体内用dWIZ-2处理的三只猕猴中有两只HbF表达增加;在28天的治疗期间没有脱靶效应。一个关键问题是dWIZ-2或相关分子是否可以转化为有效且安全的口服治疗药物。
临床前数据表明,下调WIZ可能会在体内产生高水平的HbF。值得注意的是,WIZ如何调控HbF的表达还远不清楚。WIZ是抑制性G9a–G9a样蛋白(GLP)组蛋白甲基转移酶复合体(也称为EHMT1-EHMT2复合体)的核心成分。作者提出,WIZ因此通过减少HBG1和HBG2基因启动子处的抑制性组蛋白H3 Lys9(H3K9)二甲基化来作为HbF表达的负调节器。因此,降解WIZ移除了对HbF表达的这一抑制(见图)。
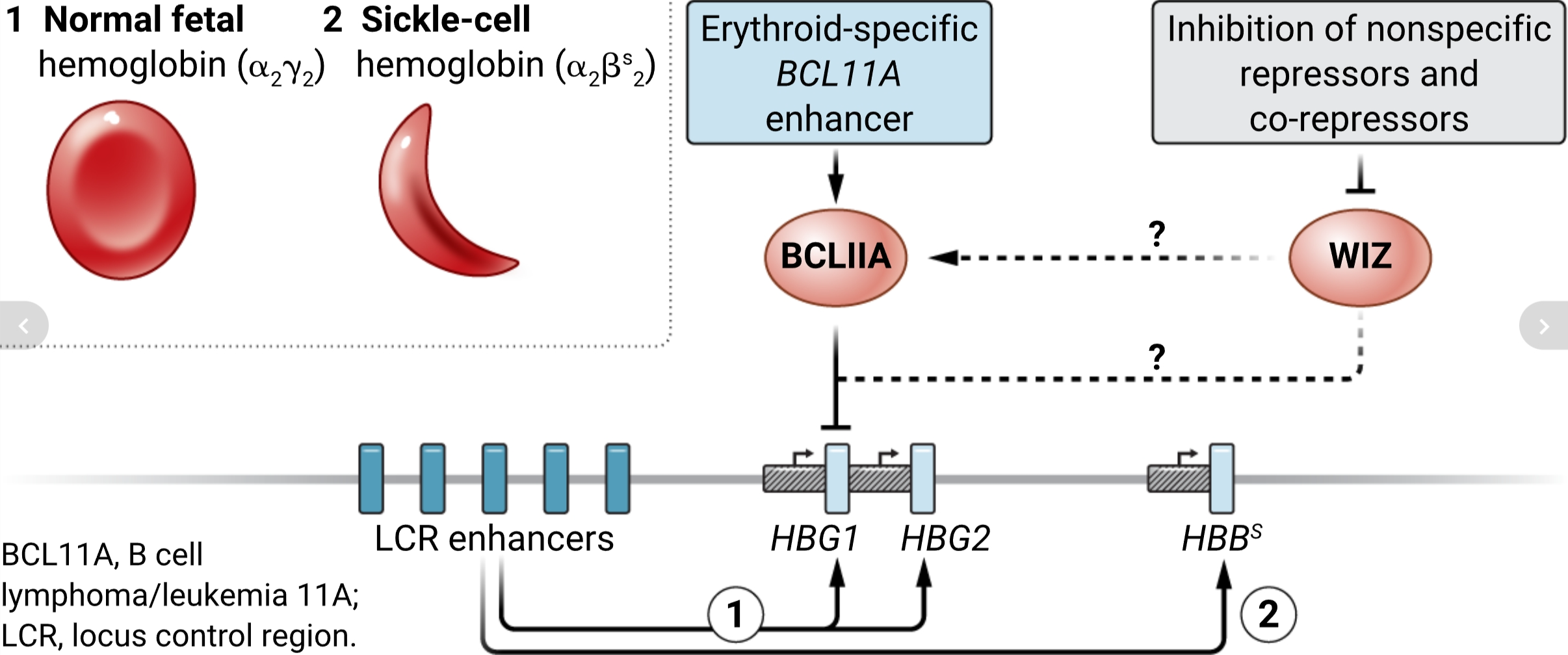
应当注意的是,像其他表观遗传修饰剂一样,WIZ在基因组中广泛结合,包括增强子、启动子和CTCF结合的绝缘子,这预示着它参与了众多基因的表达。它还在各种组织中广泛表达:小鼠中WIZ的突变和干扰G9a-GLP复合体会导致广泛的发育异常并在中到晚孕期间致命(10)。在人类中,WIZ和G9a-GLP复合体的突变与一系列遗传疾病有关。此外,G9a和GLP在神经障碍、癌症进展、免疫细胞分化和心脏(11)中有重要作用。因此,希望dWIZ-2将提供一种安全提高HbF表达的新途径,并且不会走上许多最初有希望的表观遗传修饰剂因提出的用途而失败的道路。.
https://wap.sciencenet.cn/blog-41174-1441098.html
上一篇:FDA批准的第一种活细胞癌症药物
下一篇:偏头痛原因是脑子有病