博文
BAM|中山大学附属口腔医院龚启梅和韦曦团队:低氧预处理牙髓干细胞来源小细胞外囊泡有效缓解炎症性骨溶解进程
||
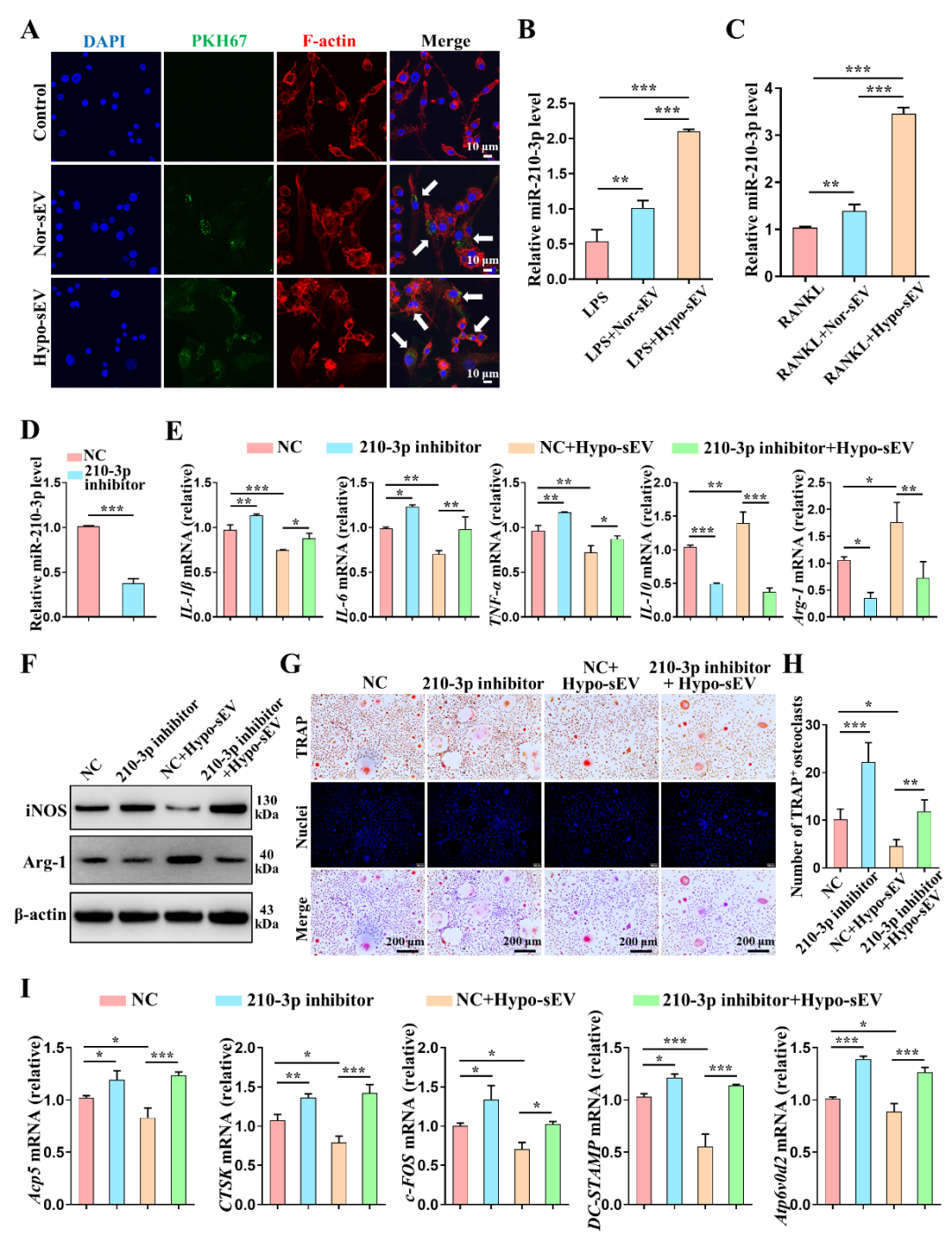
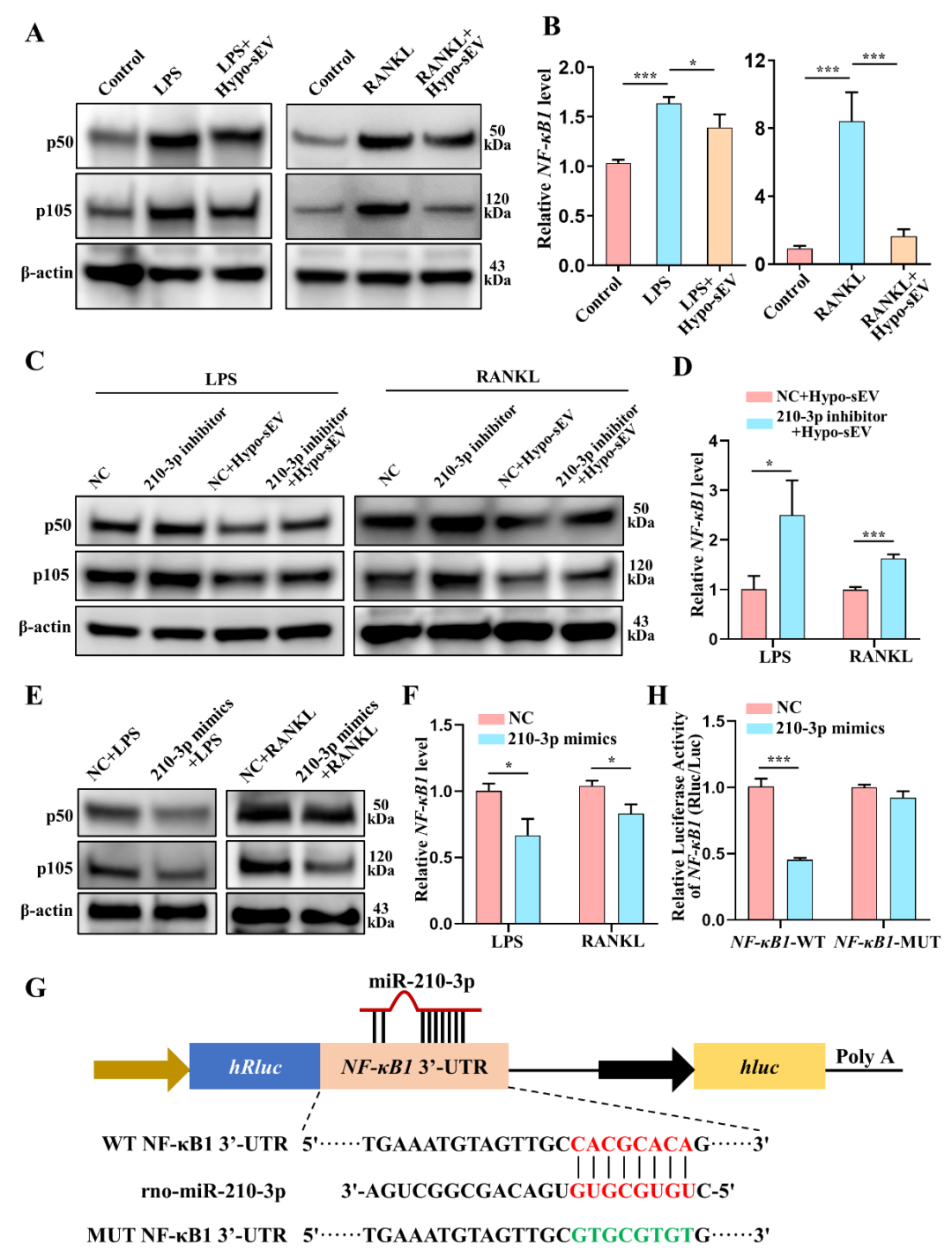
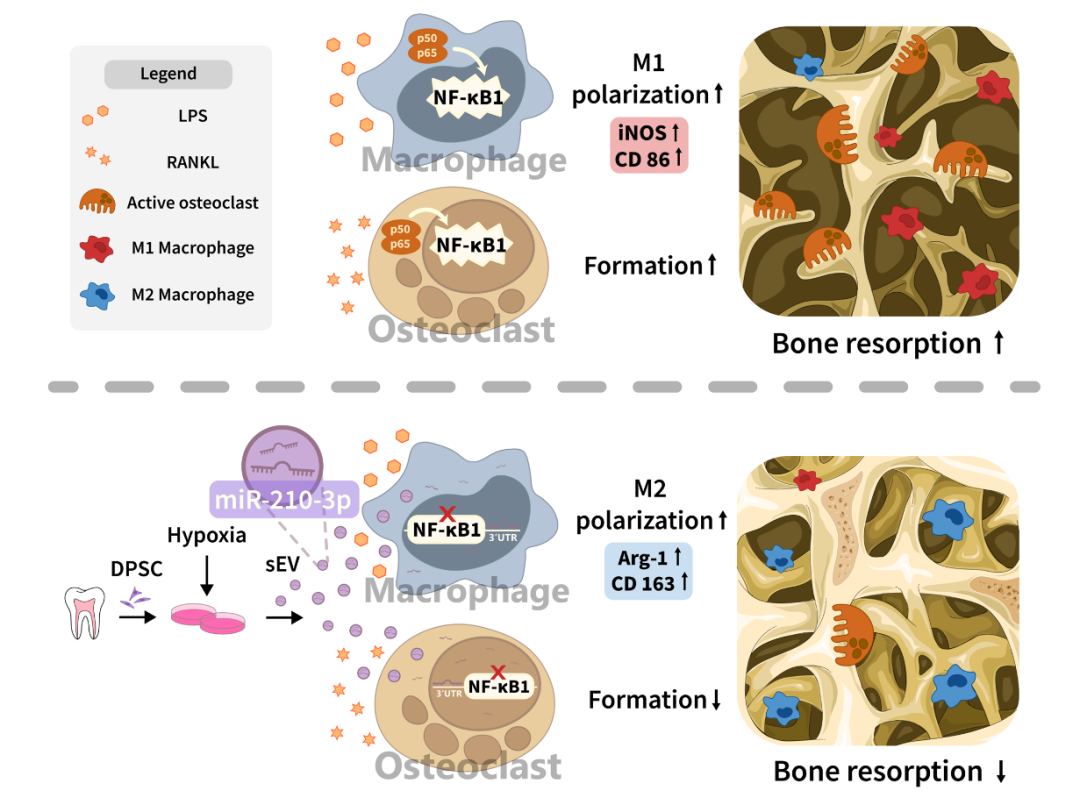
近期,中山大学附属口腔医院龚启梅副教授和韦曦教授在科爱创办的期刊Bioactive Materials上发表了题为“Small extracellular vesicles derived from hypoxic preconditioned dental pulp stem cells ameliorate inflammatory osteolysis by modulating macrophage polarization and osteoclastogenesis”的研究论文。报道了低氧预处理可促进牙髓干细胞(DPSCs)释放小细胞外囊泡(sEV);与常氧来源DPSC-sEV(Con-sEV)相比,低氧来源DPSC-sEV(Hypo-sEV)富集并传递miR-210-3p,靶向结合NF-κB1,诱导巨噬细胞M2向极化与抑制破骨细胞形成的能力均增强,进而改善小鼠颅骨炎症性骨吸收损伤,促进组织修复。本研究为炎症性骨溶解疾患修复再生的微创生物治疗提供实验依据和干预手段。 01研究内容简介 在炎性骨吸收或溶解疾病中,如骨髓炎、牙周炎、种植体周围炎、类风湿性关节炎 (RA) 和化脓性关节炎等,单个核/巨噬细胞被募集并向促炎的M1型极化。持续激活的M1巨噬细胞产生大量促炎细胞因子,诱发炎症级联反应以及破骨细胞过度形成和活化。诱导巨噬细胞M2向极化、抑制破骨细胞形成,已被认为是治疗炎性骨吸收的有效策略。目前常用的抗骨吸收药物,包括双膦酸盐、组织蛋白酶K抑制剂和RANKL抑制剂(如地诺单抗),可有效抑制骨吸收,但存在一定副作用,包括具有肾毒性、诱发过敏反应和颌骨坏死等。因此,亟待研究新的治疗方案来治疗和预防炎症性骨吸收。 牙髓干细胞(DPSCs)是从成人牙髓中分离出来的间充质干细胞。其来源广泛,可从拔出的牙齿中获取,不会引起伦理问题。与经典的骨髓间充质干细胞 (BMSCs) 相比,DPSCs 增殖率更高。此外,据报道,DPSCs来源小细胞外囊泡(DPSC-sEV)显示出比 BMSC-sEV 更强的免疫调节功能。DPSC-sEV 也被证实对皮肤伤口、脊髓损伤以及下颌骨和颅骨缺损具有治疗作用。然而,目前尚不清楚 DPSC-sEV 是否可通过同时直接抑制巨噬细胞炎症反应和破骨细胞生成以促进炎性骨吸收修复再生。 体外培养或扩增的 MSCs 通常暴露于常氧(21% O2),这与自然生理条件下体内的氧浓度不同。事实上,体内很大一部分 MSCs 存在于缺氧环境中,氧气浓度范围为 2%–8% 甚至更低。研究显示,低氧有助于维持 MSCs增殖、分化和自我更新潜能,同时增强MSC-sEV的生物活性。然而,低氧能否增强 DPSC-sEV诱导巨噬细胞M2向极化和抑制破骨细胞生成,进而更好促进炎性骨吸收修复再生尚不清楚。 该研究发现低氧(1%O2)预处理可促进DPSC-sEV的释放。通过构建LPS 诱导的颅骨炎性骨吸收模型验证常氧来源DPSC-sEV(Nor-sEV)和低氧来源DPSC-sEV(Hypo-sEV)的疗效,发现Nor-sEV 未能显著减轻LPS诱导的炎性骨吸收,而Hypo-sEV显著减少炎症细胞浸润,增加 BV/TV ,减少骨侵蚀面积,表明有效抑制 LPS 诱导的颅骨炎性骨吸收,促进修复再生。进一步实验显示:Hypo-sEV可同时于体内外显著抑制巨噬细胞炎症反应以及破骨细胞形成,且抑制能力强于Con-sEV。 图1. 低氧预处理DPSC-sEV抑制LPS诱导的炎性骨吸收。 随后,研究人员探讨了低氧预处理增强DPSC-sEV治疗活性的机制。发现低氧微环境预处理显著改变DPSCs-sEV的miRNA表达谱。Hypo-sEV通过富集和传递miR-210-3p,靶向结合NF-κB1下游基因,同时发挥诱导巨噬细胞M2向极化反应和抑制破骨细胞生成的作用,进而缓解炎症性骨溶解疾病的进展。 图2. 低氧预处理DPSC-sEV经传递miR-210-3p同时抑制炎性巨噬细胞反应及破骨细胞形成。 图3. 低氧预处理DPSC-sEV中MiR-210-3p靶向结合NF-kB1。 综上,该研究揭示了低氧预处理DPSCs-sEV的“一石二鸟”双效治疗作用,提示其在改善和调控骨组织炎症微环境方面极具应用前景。此外,明确了miR-210-3p通过靶向结合NF-κB1同时抑制巨噬细胞炎症反应和破骨细胞生成的新作用,为炎症性骨溶解疾患修复再生的微创生物治疗提供实验依据和干预手段。 图4. 低氧预处理DPSC-sEV抑制炎性骨吸收示意图。 02论文第一/通讯作者简介 第一作者:田俊 中山大学附属口腔医院主治医师。主要从事间充质干细胞及胞外囊泡免疫调控、牙髓修复再生相关研究。以第一作者(含共一)于Bioactive Materials、Autophagy、International Endodontic Journal、Journal of Endodontics等期刊发表SCI论文7篇。目前主持国家自然科学基金青年项目、中国博士后科学基金面上项目各1项。 通讯作者:龚启梅 中山大学附属口腔医院,副主任医师,博士生导师。主要从事牙髓根尖周病病因及再生修复机制的研究。作为第一及通讯作者在Bioactive Materials、Biomolecules、Journal of Endodontics 等发表SCI论文十余篇。主持国家级及省部级科研项目5项。获2018年广东省杰出青年医学人才。 通讯作者:韦曦 中山大学附属口腔医院教授、主任医师、博士生导师,牙体牙髓病科主任。现任中华口腔医学会牙体牙髓病学专委会副主委,广东省口腔医学会牙体牙髓病学专委会主委。主要从事牙髓修复再生以及间充质干细胞免疫调控的研究,主持国家自然科学基金面上项目5 项,广东省自然科学基金重大基础研究培育1项。在Bioactive Materials、Autophagy、ACS Applied Materials & Interfaces、Stem Cell Research & Therapy、International Endodontic Journal、Journal of Endodontics 等期刊发表SCI 论文54 篇(第一作者/通讯作者含共通)。 03资助信息 该研究获 国家自然科学基金(81870750, 81970925, 81900994)、和广东省高水平医院建设“登峰计划”(174-2018- XMZC-0001-03-0125/D-08)的支持。 04原文信息 Jun Tian, Weiyang Chen, Yuhua Xiong, Qianer Li, Siyi Kong, Mengjie Li, Chunfeng Pang, Yu Qiu, Zhezhen Xu, Qimei Gong, Xi Wei. Small extracellular vesicles derived from hypoxic preconditioned dental pulp stem cells ameliorate inflammatory osteolysis by modulating macrophage polarization and osteoclastogenesis. Bioactive Materials, 22 (2023) 326–342. Bioactive Materials是一本高质量英文期刊,目前已经被SCIE、PubMed Central、Scopus、Embase收录。同时本刊还入选了2019年中国科技期刊卓越行动计划--“高起点新刊”项目。 2022年Bioactive Materials 获得影响因子16.874 ,在Materials Science,Biomaterials领域排名第一。 位于《2021年中国科学院文献情报中心期刊分区表》1区,TOP期刊。 CiteScore 2021: 14.3。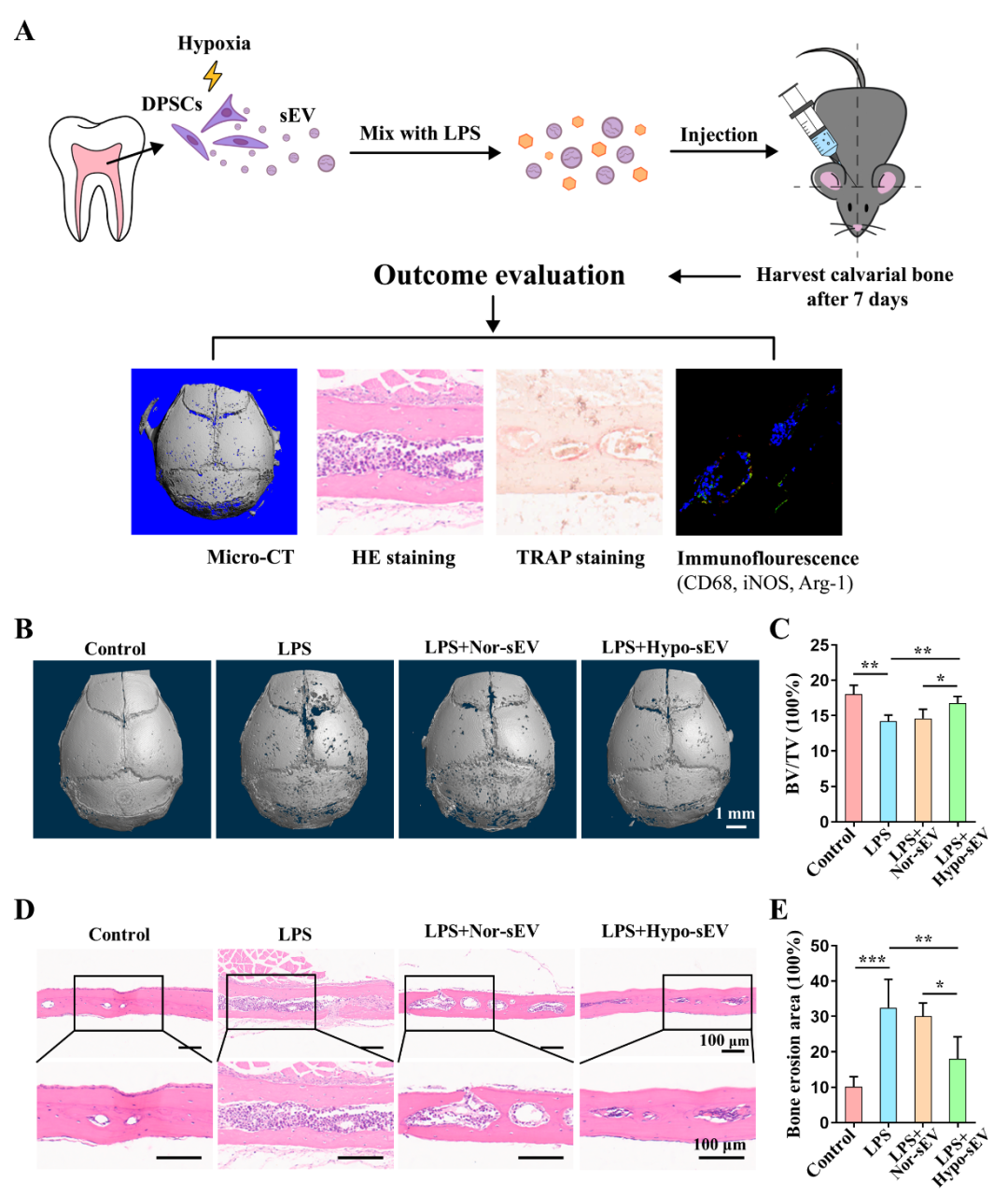

https://wap.sciencenet.cn/blog-3496796-1384088.html
上一篇:SSB | 新加坡科技研究局A*STAR:经济高效的混合长短读长测序组装法描绘高GC含量的替代链霉菌宿主用于天然产物开发
下一篇:2022年度高下载量文章免费下载!