博文
国家临床研究网络架构与运行机制研究
||
国家临床研究网络架构与运行机制研究
贾晓峰 殷环 陈娟
中国医学科学院医学信息研究所
随着经济、社会的发展,我国居民健康水平和生活质量快速提升的同时疾病模式也发生着快速转变。自上世纪80年代,以心脑血管疾病、恶性肿瘤、慢性阻塞性肺疾病和代谢系统疾病为代表的慢性非传染性疾病逐渐占据了较大比重,重大传染病威胁持续存在,新发传染病不断出现;另一方面,快速的全球化、工业化、城镇化和人口老龄化也给居民健康带来严峻挑战。围绕提升居民健康水平和生活质量的科技领域,创新医学科技发展,是国家医学科技发展的总体战略需要。
疾病预防、诊断和治疗规范(临床路径、指南、专家共识等)和相关科技标准是指导疾病预防、诊疗和相关科技活动的规范化措施,是全链条医学科技创新中最为重要的环节。而当前我国疾病防、诊、治的规范和相关技术标准多是在西方国家人群研究证据上发展而来,缺乏在我国人群中的安全性和有效性评估。由于我国人口不同种族和民族遗传背景、生活环境和生活方式的多样性及其与西方人口的较大差异,直接采用西方的研究证据会导致大量的不合理诊疗,因此我国迫切需要通过开展高质量、大人群、长期的临床研究(尤其是多中心随机对照试验研究),加快积累并形成一系列适合本国人群的特点、安全有效的疾病防、诊、治证据和规范,构建我国临床诊疗循证的医学基石,支撑临床诊疗的安全性和有效性。
当前,国际上高质量的临床研究需要科学的设计、严格的质控、大规模的人群、长期的跟踪研究和多中心共同参与实施完成,具有技术难度高、资金需求量大、质控困难、管理协调工作量大等特点。通过搭建国家临床研究网络,有效集成研究资源、规范研究过程、高效链接基础研究和转化应用、集成化协同开展研究,提升临床研究的效率和质量,是当前国际主流的研究模式。国际典型医学科技发达国家均在积极完善建设国家临床研究网络,如英国国家临床研究联盟、美国NIH艾滋病、肿瘤临床研究网络等。我国临床研究长期存在着“重复分散”和“孤岛”等问题,长期依靠少数、小范围、分散的研究力量开展,基础薄弱、水平落后,研究成果质量差且不能有效的转化应用,使得原本不足的科技资源长期处于分散、低效的配置状态。借鉴国际相关经验,根据我国特点探索研究搭建国家临床研究网络,利用我国较大的人口基数和丰富的患者资源,开展规范、科学的临床试验研究,提高我国临床医学研究的质量,推动临床研究成果的转化应用,扭转临床证据“输入国”为“输出国”,为我国疾病防诊治提供科学的解决方案并为世界疾病规范性、个体化的防诊治策略的发展奠定基础,是我国医学研究模式创新发展的重要任务。
(一)我国临床研究发展现状和问题分析
临床研究是医学研究的一个重要类型。它是以疾病的诊断、治疗、预后、病因和预防的策略和产品为主要研究内容,以患者为主要研究对象,以医疗服务机构为主要研究基地,由多学科人员共同参与组织实施的科学研究活动。临床研究的类型较多,既包括临床试验、队列研究、病例对照研究、横断面研究、病例系列研究及病例报告等原始研究,还包括系统评价(systematic reviews,SR)/Meta分析、临床实践指南、临床决策分析、临床证据手册、卫生技术评估和卫生经济学研究等二次研究。临床研究具有高技术门槛、高资金和人员投入、高水平管理要求等特点。我国对药物的临床研究监管较早,在本世纪初就相继颁布了《药物临床试验管理规范》、《药品临床研究的若干规定》、《药物临床试验质量管理规范》等一系列文件,对药物的临床研究过程管理的规范性起到了很大的作用。但是对于更为广泛的临床研究的规范化管理工作近几年才逐渐开展,2014年国家卫生计生委、国家食品药品监督管理总局、国家中医药管理局联合出台了《医疗卫生机构开展临床研究项目管理办法》,对医疗机构开展临床研究项目的组织、立项、财务、实施和监督等内容进行了明确的规定。我国已开始重视临床研究,研究逐步规范,但研究的规范化管理和质量控制等环节依旧存在非常严峻的问题,顶层设计依旧薄弱,相关研究亟待开展。
1.我国临床研究项目的现状及问题分析
(1)我国临床研究能力偏弱,但增长迅速
美国ClinicalTrials.gov是由美国国会授权,国际医学期刊编辑委员会(ICMJE)和美国FDA共同推动实施的临床试验注册平台。ClinicalTrials.gov接受全球范围的临床试验的注册,是目前国际最为全面的临床试验注册网站。分析显示,截止到2015年12月31日,ClinicalTrials数据库中共收录了全球180多个国家和地区超过20万项临床研究项目,主要集中在北美洲,其次是欧洲,我国(包括香港地区)的临床研究项目共8318项,占全球的4.0%,远少于美国(90384项)、加拿大(14855项)等,同时如果考虑到我国庞大的人口数,我国临床研究活跃度指数(项目数/万人)仅为0.06,远低于世界平均水平0.28(表1)。
表1 ClinicalTrials收录的全球临床研究项目国家排名情况
国家 | 项目数 | 百分比(%) | 排序 | 研究活跃度(项目数/万人) |
美国 | 90384 | 43.7 | 1 | 2.81 |
加拿大 | 14855 | 7.2 | 2 | 4.13 |
德国 | 13900 | 6.7 | 3 | 1.72 |
法国 | 13680 | 6.6 | 4 | 2.12 |
英国 | 11479 | 5.6 | 5 | 1.77 |
意大利 | 8392 | 4.1 | 6 | 1.40 |
中国(含香港) | 8318 | 4.0 | 7 | 0.06 |
西班牙 | 8009 | 3.9 | 8 | 1.74 |
韩国 | 6890 | 3.3 | 9 | 1.37 |
荷兰 | 6587 | 3.2 | 10 | 3.89 |
比利时 | 6417 | 3.1 | 11 | 5.68 |
以色列 | 5519 | 2.7 | 12 | 6.84 |
丹麦 | 5335 | 2.6 | 13 | 9.41 |
澳大利亚 | 5023 | 2.4 | 14 | 2.10 |
巴西 | 4807 | 2.3 | 15 | 0.23 |
波兰 | 4389 | 2.1 | 16 | 1.14 |
瑞士 | 4331 | 2.1 | 17 | 5.22 |
台湾 | 4262 | 2.1 | 18 | 1.82 |
瑞典 | 4249 | 2.1 | 19 | 4.34 |
日本 | 3966 | 1.9 | 20 | 0.31 |
全球 | 206739 | 100 | 0.28 |
数据来源:ClinicalTrials(检索日期:2016-03-03),United Nation-2015年各国人口数
然而对2005年以来在ClinicalTrials和中国临床实验注册中心(ChiCTR)上注册的我国临床试验项目数量进行分析,结果显示近10年我国临床实验项数量呈稳步增长态势(图1)。

数据来源: ClinicalTrials、ChiCTR
图1 国内临床研究/试验项目的增长趋势
(2)我国临床研究能力地区差异较大,近半数的研究主体是外企
根据中国临床试验注册中心(ChiCTR)数据分析显示,截至2016年1月6日,我国共有14615项临床注册试验,主要集中在北京、上海、广东等地,华东、华北和华南各省份的平均注册量显著多于其他地区(图2、表2所示)。
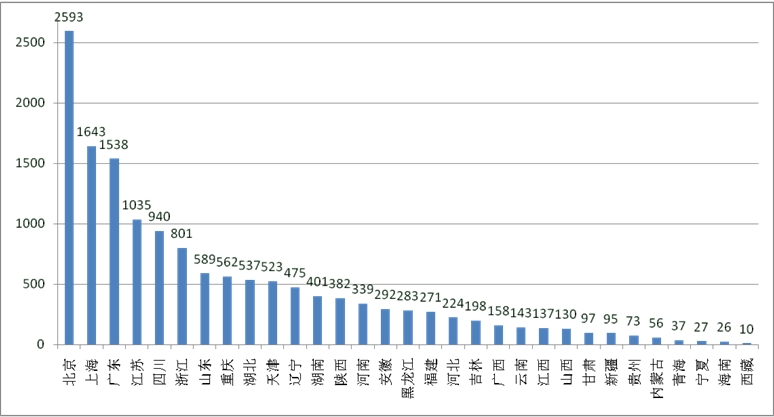
图2 ChiCTR注册的临床试验项目地区分布
数据来源:ChiCTR(检索日期:2016-01-06)
表2 ChiCTR注册的临床试验项目地区分布
地区 | 省份 | 临床试验项目总数 | 省平均数 |
华东 | 山东、江苏、安徽、浙江、福建、上海 | 4631 | 772 |
华北 | 北京、天津、河北、山西、内蒙古 | 3526 | 705 |
华南 | 广东、广西、海南 | 1722 | 574 |
西南 | 四川、云南、贵州、西藏、重庆 | 1728 | 346 |
华中 | 湖北、湖南、河南、江西 | 1414 | 354 |
东北 | 辽宁、吉林、黑龙江 | 956 | 319 |
西北 | 宁夏、新疆、青海、陕西、甘肃 | 638 | 128 |
数据来源:ChiCTR(检索日期:2016-01-06)
根据ClinicalTrials数据平台分析显示,在我国开展的7072项临床研究项目的研究主体以国内知名医学院校和外企为主(表3);排名前15的研究机构共开展临床研究2213项,其中30%(657项)由诺华、阿斯利康、葛兰素史克、辉瑞、拜耳、罗氏等国外大型医药公司实施(表3)。
表3 ClinicalTrials收录的中国临床试验项目主办单位(Sponsor)
序号 | 英文名称 | 中文名称 | 数量 |
1 | Sun Yat-sen University | 中山大学 | 380 |
2 | Fudan University | 复旦大学 | 201 |
3 | Chinese Academy of Medical Sciences | 中国医学科学院 | 198 |
4 | Shanghai Jiao Tong University School of Medicine | 上海交通大学医学院 | 165 |
5 | Chinese University of Hong Kong | 香港中文大学 | 158 |
6 | Peking University | 北京大学 | 156 |
7 | Novartis Pharmaceuticals | 诺华公司 | 133 |
8 | AstraZeneca | 阿斯利康公司 | 121 |
9 | GlaxoSmithKline | 葛兰素史克 | 108 |
10 | Xijing Hospital | 西京医院 | 108 |
11 | Pfizer | 辉瑞 | 104 |
12 | The University of Hong Kong | 香港大学 | 101 |
13 | Bayer | 拜耳公司 | 98 |
14 | Hoffmann-La Roche | 豪夫迈·罗氏公司 | 93 |
15 | Nanjing Medical University | 南京医科大学 | 89 |
数据来源:ClinicalTrials(截止日期:2015-12-31)
(3)我国缺乏多中心、大人群、高质量、规范的临床研究
临床研究以多中心、大人群、长期前瞻随访性研究所得到的研究结论证据力度较大,国际疾病防、诊、治技术规范和标准制定的时候多采信此类研究。国际上最早的大人群队列研究可以追溯至20世纪40年代,以美国弗雷明汉心脏研究、英国的国家儿童出生队列、美国护士健康队列和欧洲癌症与营养前瞻性队列等为代表的队列研究较为著名,这些研究阐明了体力运动、膳食营养、生活习惯和遗传因素以及社会和心理因素等在心血管疾病、脑卒中、肿瘤以及儿童疾病等病因学方面的作用,为发展相应的疾病预防措施提供了人群研究证据。
我国的队列研究起步相对较晚,自20世纪70年代陆续建立了一批不同规模的人群队列,但是仍然存在许多问题,如前瞻性人群队列研究起步较晚,数量不多,研究分散,规模多数较小,且缺乏长期、稳定支持,随访时间短等。由于现阶段随访时间仍然较短,可产出的高质量人群病因学证据仍然有限,大多数国人相关的病因学证据仍然停留在病例对照研究、病例系列研究和横断面研究等因果证据强度较低的设计。
2.我国临床研究人员及机构的现状及问题分析
(1)临床研究人员精力不足、专业不全面
临床研究主要由3类人员开展实施:研究者、协助研究人员、和质量监管人员。研究者是临床研究的第一执行人,其主要职责包括:招募受试者并获取知情同意书;严格执行试验方案;将试验数据准确载入病历和病例报告表;配合监查、稽查以及视察工作;试验中保障受试者安全等。协助研究人员包括:1)护士:负责试验用药的领取、发放(或给药)及返还,观察并记录受试者用药后的生命体征变化,不良事件发生后的应急处理和抢救,对受试者的依从性管理;2)药师:配制和管理试验用药;3)医技人员:文件和仪器管理。质量监管人员方面,对于药物临床试验而言,GCP规定由申办方派遣CRA(Clinical Research Associate)定期对临床研究机构进行监查,药品监管部门也会定期对临床研究机构进行稽查或视察;对于国家资助的临床研究而言,项目管理方要求研究人员定期提交进展报告,以保证项目顺利进行,研究团队也要有专门的质控人员负责从研究设计到成果转化环节的全流程的质控。
我国当前临床研究的职责过于集中于研究者,而研究者由于精力有限、专业性不全面,研究的整体质量难以提高。国内的临床研究者主要为临床医生,临床医生要在完成沉重的医疗、教学任务的同时开展临床研究工作,而在研究工作中同时兼任研究者、协助人员和质量监管等多种角色,多数情况下要全面负责研究设计、实施、质控以及科研伦理等事务。由于临床研究质量要求非常严格,精力不足导致的记录不准确、研究者未能与受试者有效沟通导致的依从性差、失访严重、研究方案背离等问题将最终影响研究的进程和结果。另一方面,我们当前很多临床研究的协助研究人员往往是临时调派,由于专业度不够导致研究质量无法保证;而研究质量监管也多属于形式巡检,只能保证试验文件、设施和数据记录格式符合要求,对于研究全过程的规范和质控仍需进一步加强。
(2)我国临床研究培养体系尚不健全
国内临床研究人员所接受的学校医学本科教育中关于临床研究方法学的知识相对较少,研究生教育的时间多集中在住院医师临床技能的培养,继续医学教育中也缺乏基本的规范化系统培训,从而导致多数研究者临床试验设计能力、质量控制能力和临床试验的风险把控能力较弱,对研究中新技术和理念的了解都处于较低的水平。此外,我国临床研究人员对临床研究相关法规缺乏了解,致使临床研究质量难以保证,伦理问题突出。虽然我国早已颁布并实施《药品临床试验管理规范》、《药物临床试验质量管理规范》。然而,仍有较多部分研究者对GCP不够熟悉,对实施GCP的重要性缺乏认识,尚存在随意涂改试验数据、人为补齐数据、甚至有在未经伦理委员会批准的情况下开展研究等现象。
(3)我国临床研究机构数量偏少且地域分布不均
国家食品药品监督管理总局CFDA已认定的临床试验机构为512家,均为三级医院(截至2016年3月3日),而我国当前有科研职能的三级医院约有3000余家,具有药物临床试验资格认证的医院仅占六分之一,且具有临床试验认证资格的机构主要集中分布在华东和华北地区(占全国总署的50%以上)(表4)。
表4 CFDA认定的药物临床试验机构分布
地区 | 省份 | 临床试验机构总数(百分比%) | 人口总数(万人) | 机构:万人 |
华东 | 山东、江苏、安徽、浙江、福建、上海 | 161 (31.4) | 35572 | 1:221 |
华北 | 北京、天津、河北、山西、内蒙古 | 110 (21.5) | 17206 | 1:156 |
华中 | 湖北、湖南、河南、江西 | 73 (14.3) | 26531 | 1:363 |
华南 | 广东、广西、海南 | 64 (12.5) | 16381 | 1:256 |
东北 | 辽宁、吉林、黑龙江 | 40 (7.8) | 10976 | 1:274 |
西南 | 四川、云南、贵州、西藏、重庆 | 35 (6.8) | 19671 | 1:562 |
西北 | 宁夏、新疆、青海、陕西、甘肃 | 29 (5.7) | 9909 | 1:342 |
总计 |
| 512 (100) | 136246 | 1:266 |
数据来源:临床试验机构总数来源于CFDA(检索日期:2016年3月3日),人口总数来源于国家统计局网站(统计时间截止2014年底)
(4)临床研究机构的管理不够规范、存在各方面的问题
我国临床研究机构尚存在管理不规范等各方面问题。国家食品药品监督管理局于2009年11月启动对我国238家临床试验机构的质量复核,2012年12月底检查结果显示近半数临床试验机构的质量保证体系和组织管理存在问题,绝大部分机构的试验记录不规范,试验实施和试验药物管理不规范,独立伦理委员会的审查制度和SOP可操作性差。
不同临床研究机构之间缺乏统一的数据管理体系,难以高质量地完成多中心研究。临床研究的数据管理包括采集病例报告表(CRF)、审核并录入CRF、数据审核、数据库锁定等过程。我国临床研究机构在开展临床研究期间一直延续着手工记录、纸张提交和书面审查的传统方式,这使得研究过程中不能及时发现问题和及时沟通,人为因素大,进而导致研究数据的可靠性难以保证。我国应尽快建立一套规范化信息传递过程的电子标准,加快我国临床研究中IT技术的应用步伐。
表5 国家食品药品监督管理局上一轮机构复核过程中发现的问题
问题分类 | 具体问题 | 机构数 | 百分比(%) |
临床试验机构 | 质量保证体系不合格 | 113 | 47.4 |
| 组织管理体系不合格 | 99 | 41.7 |
| 资料管理体系不合格 | 59 | 24.8 |
| 试验药物管理体系不规范 | 41 | 17.4 |
| 培训职能不到位 | 38 | 16.1 |
| 检验科室技术问题 | 1 | 0.4 |
伦理委员会 | 伦理审查制度和标准操作规程的可操作性差 | 51 | 21.3 |
| 成员的组成、能力和经验不合格 | 45 | 18.8 |
| 伦理审查记录不规范 | 34 | 14.3 |
| 文件存放设施及存档不合格 | 28 | 11.8 |
| 培训职能不到位 | 24 | 10.0 |
| 试验方案与知情同意书的修改及严重不良事件审查不规范 | 18 | 7.4 |
| 跟踪审查不到位 | 18 | 7.4 |
试验项目 | 试验记录不规范(含原始资料保存、病例报告表填写、原始病历书写等) | 204 | 85.7 |
| 试验实施不规范 | 114 | 47.8 |
| 试验用药管理不规范 | 101 | 42.6 |
| 知情同意不到位 | 57 | 23.9 |
| AE和SAE处置不规范 | 53 | 22.2 |
| 试验方案和总结报告不规范 | 18 | 7.4 |
| 试验前准备不充分 | 11 | 4.8 |
注:复核机构总数为238家
(二)我国临床研究网络现状及临床研究管理存在的问题
2012年起科技部联合国家卫生计生委通过形式审查、能力评估、综合评审、发文确认和社会公示等评审环节,分三个批次启动了11个重点疾病领域的32家国家临床医学研究中心建设工作。自建设工作启动以来,国家临床医学研究中心及协同网络建设工作开局良好、进展顺利,在集聚创新资源、优化组织模式等方面发挥了积极的作用,呈现出良好的发展态势。根据《国家临床医学研究中心管理办法(试行)》的规定,国家临床医学研究中心作为临床医学研究的领跑者,要发挥好引领、集成、带动、普及作用,努力建设成为整合集成临床医学研究资源和创新力量的重要依托,成为优化组织实施相关疾病临床研究和转化医学发展成果的主体研究力量,成为促进医学科技成果普及普惠的重要推广平台,为国家医学科技发展和医改实施提供科技支撑。但我国临床医学研究网络的宏观架构尚缺乏国家层面统一规划,相关工作仍需进一步推进。我国当前仍未形成有效的多层级临床研究网络,仍然有很多问题需要解决,主要体现在以下方面。
1.临床研究机构间定位不清晰,相互孤立导致研究的低效
我国国家临床医学研究中心建设启动较晚,且国家临床医学研究中心在整个国家临床研究网络中所处的位置和发挥的作用尚不够明确,各中心更多地是基于已有的研究基础,承担临床医学研究基本单元的职责。由于临床研究有较多的一致性和资源可共享等诸多特点,同一重点疾病领域下不同中心之间以及不同疾病领域不同中心间的协同共享机制尚属空白,虽然国家临床医学研究中心也承担着搭建疾病研究协同网络联合二、三级医院和基层医疗机构协同开展疾病防控研究的任务,但是由于我国医疗机构管理本身协同性较差、资源整合不够、卫生信息化程度较低,因此未能形成长期稳定的临床医学研究协同网络。因而,架构国家临床研究网络,由国家行业科技管理部门统一部署和规划国家临床医学研究网络运行机制,才可推动临床研究的高质量、高效率的实施。
2. 研究对象招募、随访和全程管理未能高效、高质量实施
临床研究中人群队列的招募和管理是严格质控的,是临床研究的重要基础,其直接关系着研究的质量,但同时也是最耗费资源的环节,因此如何实现人群队列高效率、高质量的招募和管理是临床研究管理的重要环节。当前我国大多临床研究由于经费和技术水平等原因,在队列招募的随机性、可比性、纳入标准等环节以及队列管理和随访等环节存在较多的问题,从而导致了研究数据质量偏低、人群代表性差或、访严重等问题,造成了严重的资源浪费。
3. 研究规范缺失,研究过程质控不严,难以保证研究质量
临床研究是一个多环节多阶段的科研实践过程,由于其研究结果直接用于指导临床实践,研究质量的控制和保障和是临床研究中最为重要环节。国际上主要通过相关研究的规范和技术两方面来保障临床研究质量,如通过医学研究报告规范(Good Publication Practice,GPP)来对研究质量进行评价,通过信息化技术辅助研究的过程质控等方面。我国当前临床研究中的各项技术规范以及相关技术均较为落后,也未能广泛普及,制定具有可操作性、广泛性、强制性的各项SOP,充分采用信息化技术并落实质量控制、监查、稽查等方面的工作仍需进一步加强。
4. 研究伦理管理有待进一步加强,受试者安全保障应进一步提升
医学伦理委员会(Institutional Review Board, IRB)最早在我国天津、北京等地逐渐开展实践,至今已有20多年的历程。从目前对全国范围或省市范围的调查中发现,我国的医学伦理的规范与管理仍存在较多问题:
(1)认证及监管制度缺位,体系不健全
法律法规仅仅规定我国的IRB主要由卫生部与药监局在宏观上进行管理,并没有赋予卫生行政部门具体的监管权限,也未设立专门的监管机构。我国目前亦无有效的认证或注册制度,仅有“伦理委员会需向国家食品药品监督管理局备案”的规定。IRB的监管工作主要由医院医务处、科研处、纪检部门承担,监管效力十分有限。
(2)教育和培训不足
当前IRB成员主要由医药相关专业人员、非医药专业人员、法律专家及来自其他单位的人员组成,构成比较复杂,并非都接受过系统医学伦理学教育。调查显示,IRB成员的教育和培训资源严重不足,课时和次数都非常少;既无强制性培训要求,亦无系统的培训教材;培训主要限于院内培训,不同机构间IRB的交流较少,限制了IRB审查能力和审查水平的提高。
(3)伦理审查质量无法保障
虽然《涉及人的生物医学研究伦理审查办法(试行)》中提到设立机构伦理委员会的部门或者机构应当根据伦理委员会委员的工作情况给予适当的报酬。但是,伦理委员会是建立在机构内的,往往缺乏独立的预算和组织结构设置,伦理委员会的经费和开展工作的场所并不是从制度上、组织结构上加以保证。另一方面,医院伦理委员会的主任及副主任委员大多是行政领导或临床主任兼职,时间无法保证的同时也缺乏伦理教育背景和相关的伦理培训,伦理委员会成员中较少有伦理学方面的专家,受人员结构及人员素质的限制,大多数医院伦理委员会的功能不能高质量的发挥。
5. 缺乏架构完善的研究信息管理系统,未能实现研究管理和研究过程的信息化管理
临床研究具有多中心参与、长期随访、人群队列和生物样本库维护信息量大、数据质量要求严格等特点,当前独立、分散的医疗信息系统无法直接服务于临床医学研究。搭建国家临床医学研究信息管理系统以实现研究管理和研究过程的管理,从而有效整合共享资源,推动研究管理的的高效化,提升成果转化的效率,是临床研究不可缺少的技术支撑。
6. 生物样本库规范化管理薄弱,样本库质量和利用率亟需提升
自上世纪70年代,欧美发达国家以及国际卫生组织率先开始投入大量资金建立大型生物样本库,且已逐步实现信息化和网络化管理。我国当前临床生物样本库主要由研究机构或医院单独出资筹建,少数由国家医院或科研机构联合筹建(中国人类遗传资源平台,上海生物样本库资源网络、北京重大疾病临床数据和样本资源库等),个别的是由第三方存储中心设立(芯超生物银行、国家化合物样品库等)。其中单个机构或医院筹建的生物样本库多依托项目建立,操作规范性较差、建设标准不统一、样本利用率较低;多个机构共同设立的样本库也存在管理协调不能统一、实体分布松散、人员素质和设备质量参差不齐、样本的共享性不足等诸多问题;相比而言第三方机构设立的生物样本库虽然基础设施和硬件一次性投入大、服务成本高,但具有标准统一、管理简单、样本一致性好等优点。总体来讲,我国生物样本库缺乏统一的规范标准和信息管理系统,生物样本的质量、共享度、利用率和样本库管理效率和规范化程度距离国际先进水平均有较大的差距。
7. 研究成果转化环节薄弱,需要平台和制度双重的支撑
当前我国医学科技成果转化应用环节十分薄弱,高校、研究院所等事业单位研究人员较少有动力研发高质量的可应用转化的科研成果并推动成果转化,而我国制药企业、实验设备企业、医疗器械企业等转化应用主体的研发能力又相对较弱。主要原因包括,我国当前知识产权、新药审批、医保药品管理等政策制度未能有效带动或促进生物医药科技成果的转化;另一方面,相比较其他工业领域,我国生物医药科技成果转化平台和产品孵育基地的数量和功能作用仍需进一步提升。
(三)国际临床研究的特点
1.架构多层级临床研究网络
世界典型国家多通过架构临床研究网络,有效整合资源,提高研究的科学性,加速研究进程和成果转化,最终有效提高临床研究效率和质量。国际典型临床研究网络如英国国家临床研究网络联盟(UK Clinical ResearchCollaboration, UKCRC),加拿大艾滋病、糖尿病等疾病临床研究网络及其在此基础上形成的加拿大临床研究联盟(Network of Networks,N2),美国NIH药物依赖和药物成瘾临床研究网络、艾滋病临床研究网络、肿瘤临床研究网络等。总体特点如下:①国家层面总体整合的临床研究网络以英国为典型,美国和加拿大临床研究网络多由国家级医学研究院或学会发起,以研究疾病分类设立;②临床研究网络整合资源丰富,囊括大量国家研究机构、慈善组织、学会、社会团体、企业、医疗机构、社区等;③世界典型国家临床研究网络一般由国家政府、国家级医学研究院或学会发起,可为综合型或单一疾病型临床研究网络,多为2-4层分层结构,国家层面的功能为整合资源、控制质量、推动转化应用及组织协调,下面各级网络单位的功能逐渐具体,主要开展制定研究策略并实施临床研究等工作;④典型临床研究网络分层标准多为按照地域或研究主题。
2004年建立的英国国家临床研究网络联盟(UKClinical Research Collaboration: UKCRC)是较为典型的多层级国家临床研究网络。在UKCRC总体战略指导下根据地域建立4个一级子网络,分别为英格兰临床研究网、北爱尔兰临床研究网、苏格兰临床研究网和威尔士临床研究网,各子网络总体目标一致、设施共享、交流合作、成果共享。一级子网络下按照地区(如英格兰临床研究网按照地区划分)或者是研究主题(北爱尔兰临床研究网、苏格兰临床研究网、威尔士临床研究网按照研究领域划分)分别建立15个、9个、7个和9个二级研究网。二级临床研究网下是由55个采用注册方式认证的临床试验单元(UKCRC RegisteredClinical Trials Units, CTUs),其作用是牵头协调高质量的多中心临床研究。该联盟整合了国家临床研究相关的利益相关者,如研究资助方、研究院、英国国民医疗保障服务系统(NHC)、第三方调解主体、生物科学/健康服务/制药企业以及病人之间的合作关系,并在此基础上,逐渐形成欧洲临床研究网(European ClinicalResearch Infrastructures Network, ECRIN),从而实现跨国合作开展多中心临床研究。该临床研究网络联盟的主要功能定位是:为研究者和出资者提供临床研究的一站式服务支持,包括人员培训、数据管理工具和标准化的临床研究规范;通过公开制度实现注册、数据和研究报告的公开透明;促进临床研究中复杂问题的交流和共同解决;保护研究者和科研伦理。

图3 英国临床研究网络联盟
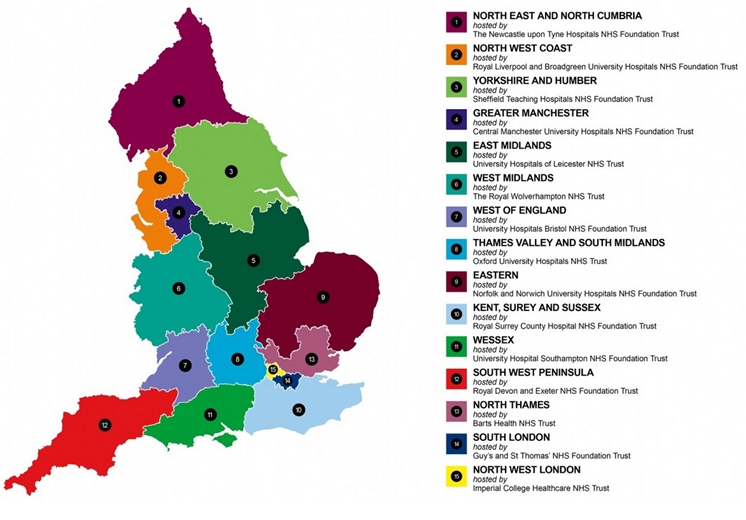
图4 英格兰临床研究网(NIHR Clinical Research Network)
加拿大较为知名的艾滋病临床研究网络也是多层级架构:①一级结构:国家中心(NationalCentre)设在温哥华,由国家中心管理委员会管理,主要开展8项工作:宏观管理和财务、交流和信息、数据服务、国际化、方法和统计分析、经济学评估、人才培养和项目管理;②二级结构:国家中心下辖核心研究组(Core Research Teams),核心组按照研究主题区分,目的是快速推动创新设计向临床研究转化,包括临床管理科学、感染和并发症、预防和易感人群和疫苗与免疫治疗;③三级结构:卫星站(SatelliteSites),是由38家诊所和医院组成;国家中心根据卫星站点的研究规模为其提供资金进行基础设施建设和协调,卫星站向国家中心定期汇报。

图5 加拿大艾滋病临床研究网络的多层级架构
2.实施高效的临床研究
英格兰的NIHR临床研究网络(National Institute forHealth ResearchClinical Research Network,NIHR CRN)整合15个临床研究子网络,按照研究疾病类型分为30类(如癌症、心血管疾病、遗传学、血液学、卫生服务等),在方便患者按照疾病类型和地理区域检索自己可以参与的临床研究的同时,帮助研究者和医药公司尽快招募到合适的患者。NIHR CRN通过资源中心向研究人员提供更多招募信息,并通过实施“NIHR CRN研究支持服务”来支持研究人员高效率地招募患者,以便进一步缩短患者招募时间,不断提高研究招募成功率和招募人数。NIHR CRN过去7年共招募了超过360万患者,2013/2014和2014/2015财年招募的临床研究患者均超过了60万,为商业合同研究招募的受试者人数持续升高;2013/14年开展的临床研究项目较之于2010/11年提高了2.5倍,2014/2015年商业研究合同研究数量相比2013/2014年增长了17%;研究立项时间大大缩短,2013/14年研究立项时间缩短43%,77%的研究在40日内获得了NHS批准开展,2014/2015年在40日内获得NHS的立项许可的研究达83%;2014/2015年,该网络为17项全球多中心研究和10项欧洲多中心研究招募了首名患者。
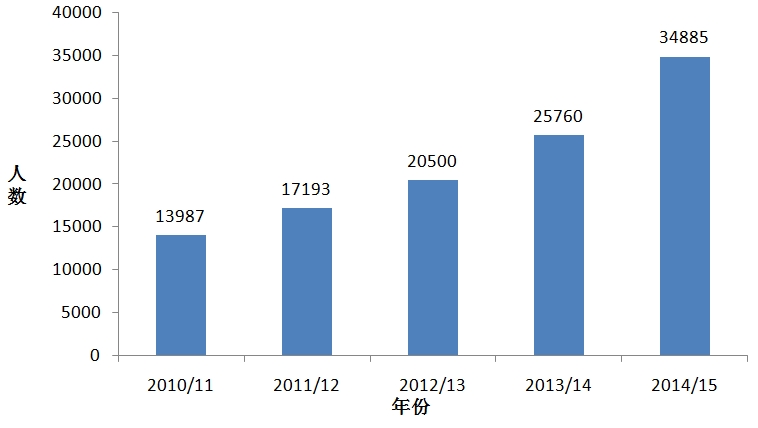
图6 NIHR临床研究网络近5年为商业合同研究招募的受试者人数
(数据来源:2014-15 NIHR CRN AnnualPerformance Report FINAL)
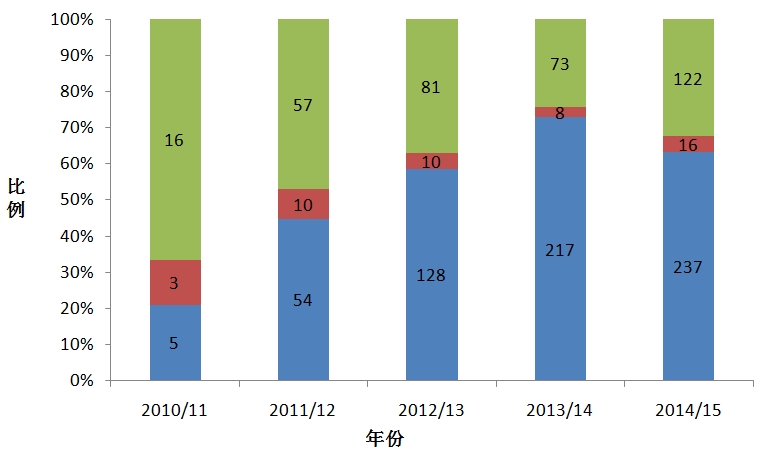
图7 NIHR临床研究网络近5年招募受试者达标情况
(数据来源:2014-15 NIHR CRN AnnualPerformance Report FINAL)
3. 建立严格的临床研究规范和标准
建立严格的、国家层面统一且涵盖医学研究设计、过程和成果转化的研究规范和标准。UKCRC在国家层面建立了标准化的人员、数据管理工具和临床研究规范、机构注册制度、患者注册制度、信息公开制度、伦理审查制度、研究质量控制规范等。加拿大临床研究网络联盟(Network of Networks,N2)是一个致力于提高国家临床研究数量和能力的一个非营利性合作组织,目前已有70多个成员组织加入了N2,这些成员参加统一培训、年度会议,并遵循统一的标准操作程序。美国、日本等自上世纪70年代先后制订了药物临床试验管理规范(Good Clinical Practice,GCP),规定临床试验必须符合赫尔辛基宣言和国际医学科学组织委员会关于人体生物医学研究的国际道德准则,包括保护受试者权益和隐私,临床试验前需经伦理委员会审批并获取受试者的知情同意等。
构建临床研究人员的培训和准入制度,提升临床研究人员的专业性,如美国临床研究专业协会(ACRR)已经在多个地区广泛开展了严格的研究护士资格认证考试,日本临床药理学会也有类似的认证制度。开展医学研究系统培训,培养医学研究人才的专业能力,如美国NIH 临床研究培训和医学教育办公室(the Office of Clinical ResearchTraining and Medical Education)针对医学生和医学研究人员开设了系统的培训计划,美国加利福尼亚大学转化医学教育项目和哈佛大学临床转化研究中心均提供多种临床研究课题培训。
4.重视临床研究伦理管理和临床研究人才培训
加强伦理审查体系建设。美国伦理委员会的建设处在行业前端,监管也别具特色。1974 年,美国成立第一个国家生命伦理委员会(IRB),该委员会建立了伦理审查制度,并建立了受试者的保护的法律法规,IRB依据联邦法规以及州的法令运作。目前,美国监管伦理委员会的主要机构是人类健康服务部(Department of Healthand Human Services,DHHS)下属的食品药品监督管理局(FDA)和人体研究保护办公室(office for human researchprotection,OHRP)。药品、生物制剂以及医疗器械等受 FDA 的主要监管,而DHHS资助的生物医学研究的受试者保护则受到OHRP监管。对于试验机构和研究者来说,FDA 的监管力度很大,FDA有权对违反法规操作的研究者、临床试验机构或伦理审查委员会进行行政处分,有权不通过他们的上市申请,甚至可以撤销伦理委员会和试验机构的资质。OHRP的主要职责是指导人体试验的伦理问题,解释和解答保护受试者的政策法规问题,并在DHHS 资助的机构有需求时,给予现场技术辅助。此外,美国建立了以对受试者的保护为中心的伦理委员会认证体系AAHRPP(Association for the Accreditationof Human Research Protection Program)认证,约有60%的大学或医院的医学伦理委员会通过 AAHRPP 认证,给受试者提供全面的保障。
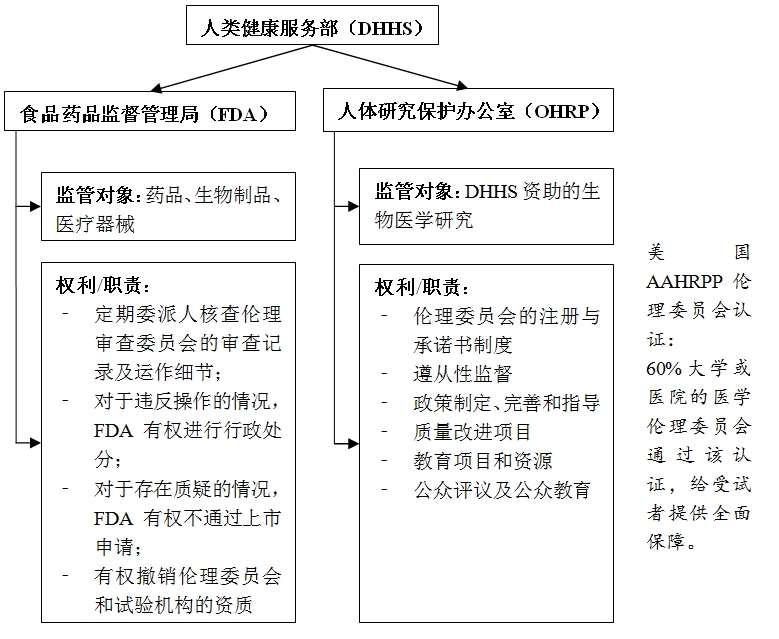
图8 美国伦理审查体系
5. 采用信息管理系统实现研究过程和研究管理的网络信息化
搭建信息管理系统,实现合理布局,有效整合共享资源,提高研究效率。英国临床研究联盟(UKCRC)搭建了数据和信息管理系统(Data and Information ManagementSystems, DIMS),通过统一的数据库和操作标准达到数据共享。英国NHS为全体公民构建了终生电子信息系统,并将其充分用于临床研究(包括研究对象招募、数据采集、结果评估等),为开展观察流行病学、临床试验、药物检测、前瞻性队列研究提供了良好的基础。英国国立卫生研究院(National Institute forHealth Research)代表英国卫生部门建设的英国临床试验门户(UK Clinical TrialsGateway,UKCTG)汇集来自多个注册机构的临床研究信息,为公众和研究者提供便捷的服务。美国儿科药理研究机构(Pediatric pharmacologyresearch units, PRU)协作研究网搭建了儿科临床数据储存库(Pediatric clinicaldata repository, PEDAR),使用统一的术语和定义来储存所有研究数据,有效推动了项目之间的数据的交换和整合。
强制实施临床试验注册登记,实现研究过程信息化和统一化管理,促进多中心临床试验的开展,如ICMJE和FDA要求临床试验须在美国临床试验注册平台(www.clinicaltrials.gov)注册,并通过该平台为全球进行的临床试验提供注册登记服务,通过网络资源为患者及家属、医疗工作人员、科研人员及大众提供涉及多种疾病的临床试验信息。
6. 加强生物样本库规范化管理,建立样本保存和共享管理机制
英国生物库(U.K Bio-bank)被认为是世界上最大的医学科研素材和资料数据库,英国的公众伦理和治理委员会和英国卫生部公布的《人体组织法案》为生物样本库规范化管理奠定了基础。英国生物库是一种国家卫生资源,是由威康信托医疗慈善机构、医学研究委员会、卫生部、苏格兰政府和西北地区发展机构联合建立的。样本库配备有独立的指导委员会、国际科学顾问委员会、项目的首席执行官及项目研究人员,大部分的委员都是来自于生物医学领域的佼佼者,保障了生物样本库能够顺利地开展工作。样本提供者在捐赠时会被明确告知其所捐赠的人体组织将被用于疾病的研究或健康状况的统计。所收集到的样本资源是对从事公益事业与健康相关的科学家与机构开放的,研究者首先通过注册提交样本的使用申请,而后由英国生物样本库的公众伦理和治理委员会进行审查,评估研究项目需消耗的样本数量是否科学合理,对于合适的项目,与申请方共同签署材料转让协议,申请费需支付相关的使用费用。在项目完成后,样本库会要求研究者反馈使用样本研究所衍生的数据信息,包括研究成果及出版物的附件,并且相关成果要注明其研究使用了该样本库的样本。公众伦理和治理委员会在英国生物样本的运作和样本的管理上发挥了巨大的作用,有效避免了样本捐献者的个人信息泄露。除此之外,英国卫生部在2004公告的《人体组织法案》对人源性生物样本的监督管理机制、捐赠、采集、处理和储存等阐明了最低安全规范。英国成就目前全球最大的生物样本库离不开各级各部的相互监督和统一管理。
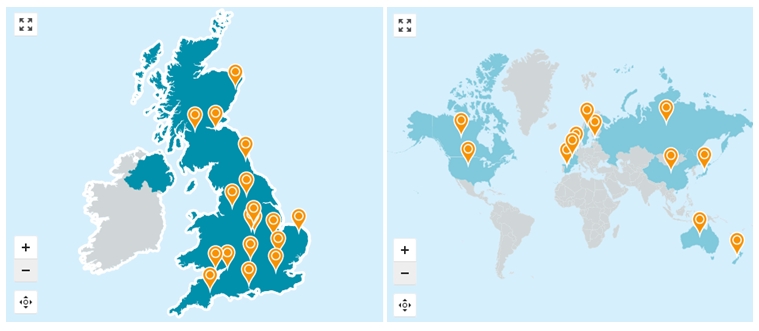
图9使用英国生物库样本资源的项目分布
美国是对人类生物资源规范化管理最早的国家,美国国家生命伦理顾问委员会和美国食品药品管理局在人类生物资源规范化管理中发挥了重要作用。在美国,首先通常由医疗机构或者样本采集部门向捐献者履行告知义务,并且获得捐赠人对将自身的组织、血液甚至基因信息等交付给研究人员处置的同意。按需求对这些人源性生物样本进行不同处理后,收归到统一的储存中心,如美国模式培养物集存库(American Type CultureConclusion, ATCC)。随后,根据不同研究机构提交的使用申请,通过签署《生物材料转移协议》来规定双方所应承担的权利义务,包括采集、使用样本过程中的责任和成果分享。从样本采集到材料转移过程都要遵循美国国家生命伦理顾问委员会(National BioethicsAdvisory Commission, NBAC)制定的伦理准则来完成。美国的食品药品管理局(Food and DrugAdministration, FDA)于1997年将人体组织物及其实验室衍生物正式纳入FDA生物制剂评估研究中心(Center of Biological Evaluationand Research, CBER)的管理体系之中,进而在2006年公布正式实施人体细胞组织物的管理制度。此外,FDA设置了血液管理部门(Office of Blood)、人体组织管理部门(Office of Tissue)和细胞基因管理部门(Office of Cell/Gene Therapy),要求凡是正规注册的各类生物样本库机构都应当接受操作规程方面的审查,各级部门的设立与管理保障了人体生物样本的使用规范。
韩国的“国家研究资源中心”(National Research ResourceCenter, NRRC)是由科学技术部1995年发起的,目前已经拥有一个总部,5个重点中心以及22所大学里的36个研究资源中心(RRCs)。2008-2012年,韩国卫生部和福利部共同提出了在国家生物样本库和区域生物样本库之间建立起一个链接的网络一一韩国生物库项目(Korea Biobank Project,KBP),KBP成功地培养和训练了一批具有专业技术的人员来从事对生物资料库的管理。为了保障人类生物资源供者的利益,韩国政府于2005年1月1日出台了《生命伦理及安全法律》,并于2013年6月对其进行了修订,旨在确保生物技术开发安全且符合生命伦理原则。直到目前为止,KBP所采集的人类生物样本只提供给研究人员使用,不对商业机构开放。
7. 建立并完善转化医学平台,促进临床研究应用转化
转化医学是国际医学发展的战略重点,国际医学科技发达国家通过建设转化医学中心有效协调各研究主体,推动研究成果转化。英国国家临床研究网络联盟以重组国家临床研究环境为主要目的,整合了国家临床研究相关的利益相关者,包括研究资助方、研究院、英国国民医疗保障服务系统(NHC)、第三方调解主体、制药企业和病人,从而最大程度地整合多方资源,提高了研究和转化效率。建于1990年的加拿大艾滋病临床研究网络由加拿大健康研究院(Canadian Institutes ofHealth Research)资助建设,临床研究者、医生、护士、HIV患者、制药商和其他HIV临床研究促进者共同参与。美国NIH成立了国家转化医学促进中心(National Center forAdvancing Translational Sciences, NCATS),作为指导转化科学发展的机构,统一规划、统一部署,在广泛征集研究者建议的基础上,通过NIH同行审议机制确定资助项目,每年投入约7亿美元支持临床与转化医学项目,并资助大学、医院及研究所建立转化医学中心,鼓励企业积极参与。截止到2013年1月,NCATS指导建立了以国家转化医学促进中心为核心,以61所(大学58所、医院2所、研究所1所)转化研究中心或临床转化科学中心为研究主体单位的转化研究组织构架。欧盟2012年提出“地平线2020”计划,将知识转化作为重点内容。目前,欧盟大约有20个国家级科研机构和政府机构正在合作打造欧洲“临床与转化科学中心”(CTSC)项目。
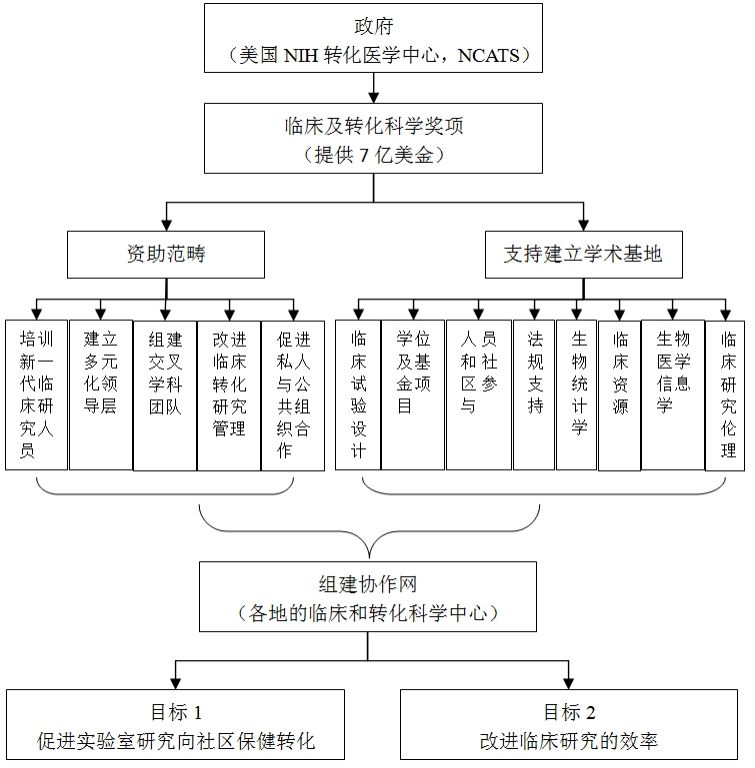
图10 美国政府对临床和转化医学研究中心的规划和支持模式图
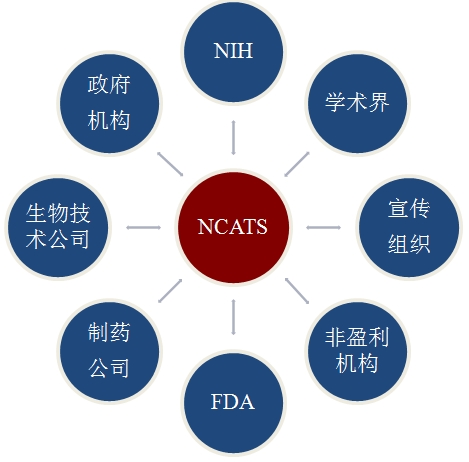
图11 美国国家转化医学促进中心催化多方合作示意图
(四)构建我国临床研究网络的建议

图12 我国临床研究网络建议结构示意图
我国临床研究网络架构的总体思想:通过顶层设计,架构国家一体的、多层次、多学科覆盖、区域平衡的国家综合临床研究网络联盟;通过相关部门的协作和标准规范的统一,实现临床研究资源的整合与临床研究高质量、高效率运行;为研究适合我国人群的预防、诊疗技术与产品提供来自本土的循证支持,从而实现以科技提升人民健康水平。
1.国家临床研究网络主体
国家临床研究网络的主体应包括:①医学科技管理部门;②公益性医学科技研究院;③医学高等院校;④各级医疗机构及社区;⑤第三方质控和评价机构;⑥其他,如社会出资方、医疗/制药企业等。
2.国家临床研究网络层次结构
国家临床研究网络联盟为三级网络,自上而下分别为:唯一的国家临床研究中心;按地区或学科分类的区域临床研究中心和临床研究单元。
(1)国家临床研究中心
国家临床研究中心是国家临床研究网络的最高核心单位,挂靠在国家级医学研究机构,由国家医学科技行政管理部门和国家级医学研究机构联合组成。
(2)区域临床研究中心
区域临床研究中心可按照地区或者临床学科区分,依据地区人群健康需求或者某医学研究领域发展水平,可分为地区型临床研究中心和学科(疾病或健康问题)型临床研究中心两种。区域临床研究中心由多家挂靠机构组成,实行轮值主席管理制。挂靠机构可为医学科研机构、医学高等院校或具有较强科研实力的综合性三级甲等医疗机构。区域临床研究中心覆盖我国华北、东北、华东、华中、西南、西北、华南各大地理分区,每个区域根据实际需求设一至多个区域临床研究中心。区域临床研究中心在国家临床研究中心制定的标准和规范下牵头实施临床研究工作。区域临床研究中心接受国家临床研究中心的指导、管理和监督,负责对下设的临床研究单元进行指导、管理和监督,并在国家临床研究中心和临床研究单元之间起到纽带和桥梁作用。
(3)临床研究单元
临床研究单元由执行临床研究的医疗机构或社区站点组成。临床研究单元由区域临床研究中心选择、准入考核并设立,根据研究需求实行不固定设置模式。临床研究单元直接接受区域临床研究中心的指导、管理和监督,配合开展相关监管工作。
3.各级临床研究网络主体的功能定位与职责
(1)国家临床研究中心
国家临床中心功能定位于:顶层设计、制度规范制定、资源整合、协调关系。国家临床研究中心负责制定国家临床研究网络发展规划;整合多途径资源,合理分配资源;制定推行临床研究相关管理制度、技术标准规范;开展成果评价及技术转化推广工作,促进研究成果向产业化和临床应用转化;成立专家咨询委员,负责临床研究网络的战略咨询和技术评价、仲裁等工作;综合协调各利益相关者关系;开展国际合作交流工作,提高我国临床研究的国际化水平;建立信息网络平台,实现研究团队和研究基地的规范认证并促进临床研究过程管理和资源、成果共享;设立人才培育项目或开展相关培训,促进临床研究人员和管理人员素质的提高并营造研究文化等。
(2)区域临床研究中心
区域中心功能定位为:组织实施临床研究、开展研究过程管理、上下联通。区域临床研究中心负责设立本区域的临床研究单元,开展研究对象信息注册;负责协调本区域的临床研究资源;负责临床研究方案的制定与实施工作,包括实施统一的质控监督,进行研究全过程管理;管理本中心负责的临床研究的所有信息资源及生物样本资源;为临床研究单元的研究实施和管理人员提供技术支持;实施伦理和实验室安全管理等工作;协助开展第三方质控、评价等工作;按需组建本区域/学科专家咨询委员,负责区域发展战略咨询和技术评价、仲裁等工作;联系国家中心和下级临床研究单元,实现信息联通等。
(3)临床研究单元
临床研究单元功能定位为:执行临床研究。临床研究单元依据所掌握的临床资源,申请参与相关临床研究工作;严格按照研究方案开展临床研究工作,并可根据实际情况反映问题、提出改进措施;协助保持研究队列并及时反馈研究过程信息。
4.相关保障措施
(1)资金投入、设施建设与人员保障
国家临床研究网络中各主体机构应予以一定额度的、稳定的资金投入,不断加强自身的基础设施建设,并设置岗位与专职人员从事临床研究管理工作,保证研究工作的顺利开展。研究资金主要来源于国家行业科研经费。
(2)制度建设
国家临床研究网络国家中心应加快顶层设计相关制度的研究和制定,明确各级主体的功能定位和宏观制度规范的建设。其他各级主体应根据各自的功能定位和职责,建立相关管理制度,规范研究过程,提高管理水平,同时探索激发创新力的相关机制,充分调动研究人员的积极性,促进高质量的成果产出。
https://wap.sciencenet.cn/blog-786113-961347.html
上一篇:2015年度我国公共卫生与预防医学学科研究热点
下一篇:中国医学科技发展报告2016 即将发布 敬请关注!