博文
“5R framework” from AstraZeneca
 精选
精选
|
“5R framework” from AstraZeneca
5R framework: the right target, right tissue, right safety, right patient and right commercial potential,主要应用在药筛早期、LO,PK/PD和药物安全性评价体系。“5R”策略大幅度提升了AZ研发部门的成功率,Phase III成功率由2005-2010年间的4%提升到2012-2016年间的19%。[1]
数年之前,人们意识到制药公司R&D部门的成功率下降的主要原因在于过度自信于药物的研发数量和质量、强力施压R&D部门致力于研究“简单”的药物而非“正确”的药物、受限的临床试验、管理难度增加、依赖于“progress-seeking”而非“truth-seeking”方向等等。人们也提出许多改进的方法,据2004年Kola和Landis给予行业基准分析,R&D部门的消耗主要由于缺少对有效性和安全性的评价,从而建议应该更关注评价毒性风险、改善临床前模型的应用、在机理验证(proof of mechanism, POM)和概念验证(proof of concept, POC)等方面收集充分的证据。[2] Scannell等人也提出“预测有效性”的概念和选对“临床前模型”的重要性,直接影响研发的成功率。
2011年AZ对R&D部门做出重要调整,致力于提高R&D的产量,有数据显示在2005-2010年间,AZ临床试验III期的成功率还只有4%,低于当时的平均值(当时医学研究中心的显示药企的平均成功率为5%),虽说大致和平均水平差不多,Phase II的成功率就更低一些,仅有15%(平均值为22%)。如此背景下,AZ选择革新,总结出“5R framework”的概念,用以指导R&D的研究方向和方法。如今的AZ缩小了研究的范围,专注研究的深度,加强了对整个课题的理解。同时还加强了对靶点的筛选和确定、先导化合物的开发、PK/PD模型的构建、病人筛选及标记分子的分析等方面的投入。过去的五年中AZ迅猛发展,在2012-2016年间产出92个小分子和10个大分子。

The 5R framework
理解正确的靶点
“5R framework”模式需要研究员在一个项目的过程中反复证实、证伪科学猜想,此后AZ缩小了研究范围的广度,而是加强了对靶点的深入研究。2005-2010间,AZ立项研发的靶点有287个,转变之后在2012-2016年间新启动的项目有76个,备选项目也有原来的~28%下降到<7%。研发模式转变后,所挑选的靶点的分类也有相应的变化,与肿瘤相关的靶点的激酶数目增多(由原来的21%增加到36%),相比而言,靶向GPCR(由25%减少到5%)和离子通道(由8%减少到2%)的项目有所下降,而其他类的新的靶点有所增加(由原来的13%增加到21%),主要包括蛋白-蛋白相互作用、转运体、生长因子、转录因子、磷酸酶、解旋酶、表观遗传酶和去泛素化酶等等,在过去人们对之研究略少。
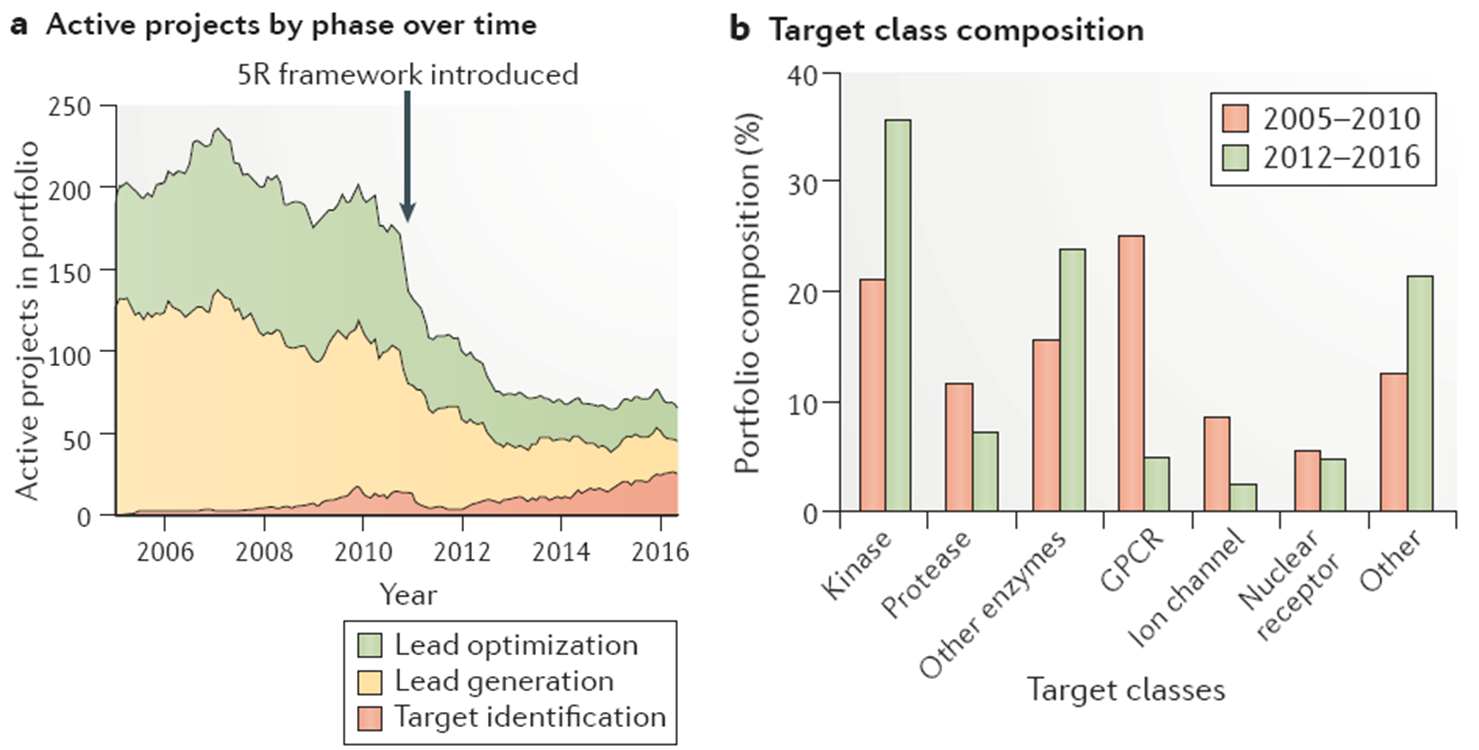
此外,随着人们对分子机制深入了解,人们所追求的药物研发角度也有所改变。不再一味的寻找竞争结合的小分子抑制剂,在激酶和其他酶靶点的项目中,也尝试选择别构调节剂。靶点和先导化合物的多样性,随之也诱发了开发策略的变革。为了更清楚的了解靶点的特性,人们建立了更多的平台,如干细胞生物学、表型筛选、精准基因编辑和基因组学,利用临床上人体组织样本、可诱导的多能干细胞技术等更清楚的了解组织水平的生物标记。探索的过程中也有新的靶点被发现,人们亟需掌握更新的生物实验方法,如化学生物学、化学蛋白组学等结合的方法,细胞水平的TSA(thermal shift assay)去筛选和评价候选化合物。[3]
基因编辑工具CRISPR和TALEN也常用于构建更合适、更相关的动物模型,也可以编辑(选择性抑制、激活或删除)靶向基因来确认化合物对靶点和通路的选择性。MTH1(也称NUDT1)是一个备受瞩目且研究透彻的肿瘤靶点,近期的工作却显示沉默MTH1基因后癌细胞依然得以存活,表明之前设计的MTH1抑制剂杀死细胞并非通过MTH1,随之AZ很快停止了该项目的研发;另外一个例子是凭借基因编辑的技术分别构建了SIK(salt-inducible kinase)三种亚型的失活突变体,再分析具体是哪一种亚型介导炎症反应。诸如此类的数据可以缩小化学部分的设计范围,高效地提升药物研发进程并精确的定位药物的选择性。展望未来,二代深度测序将会广泛的应用于药物研发早期对靶点的确定,GSK和 AZ等制药公司一致认为在从遗传学角度得以确认的靶点,会大大提高临床试验中的成功率。Regeneron Pharmaceuticals和Geisinger Health System合作,对病人体内60,000个外显子序列进行测序分析,发现比较有潜能的靶点(angiopoietin-related protein 3,ANGPTL3)被抑制后防范心血管疾病的发生。[4]如今政府和私人的团体均有开展对大规模病人和健康人群的基因组序列分析的项目,如UK、NIH和一些药企。大数据基因组的分析结合基因编辑技术,会进一步改善人们对靶点的筛选和确认。
为正确的靶点寻找先到化合物
随着靶点数目日益剧增,寻找Lead的大量新技术应运而生。主要策略还是高通量筛选,随着AZ靶向目标的范围缩小,加以早期对靶点结构的分析,HTS的项目相应有所减少,不过筛选方式的复杂性明显提升,对一个化合物的评价需要参考的参数更多,如高内涵[5]、高通量电生理、高通量的FACS[6],无标记分析、转录组学分析和声质谱分析等。
AZ的化合物库比较庞大,目前属于本公司的超过600,000个化学结构,并且随着新靶点的开发还在继续扩增,类型也在增加,比如片段、sp3样的化合物、天然化合物、大分子、核苷类和共价修饰类化合物等。此外,还通过与其他药企的共享平台可直接获得彼此的化合物库,AZ与Bayer可互通彼此完整的化合物搜集库,截止目前,约75%的项目通过此种方式发现了新的Lead;与Sanofi可交换使用210,000个化合物;还有参与Joint European compound library(JECL),与其他的药企会员间(Bayer, Janssen, Merck‑Serono, Sanofi, UCB and Lundbeck)可彼此使用500,000个新的化学结构。[7]
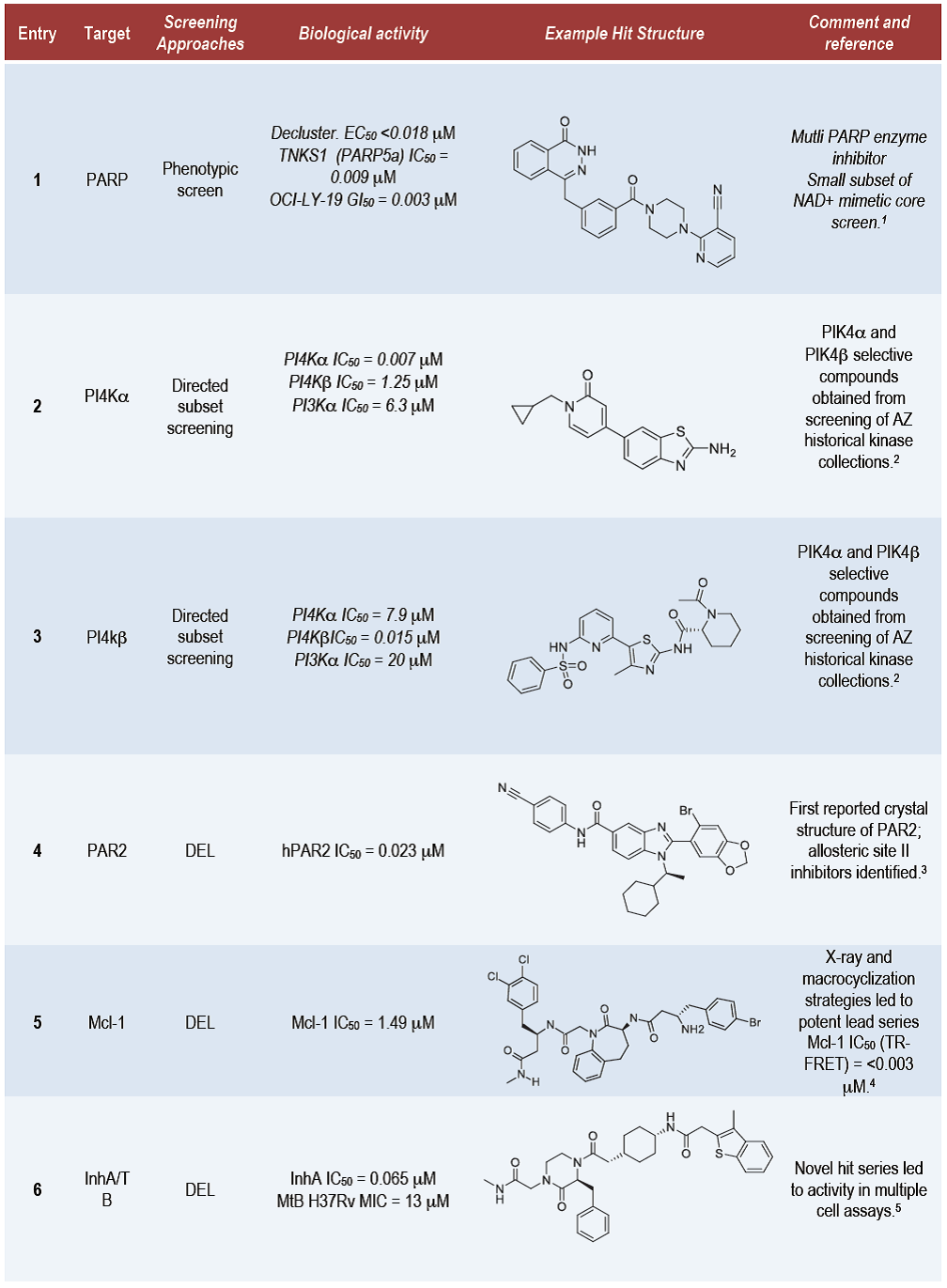
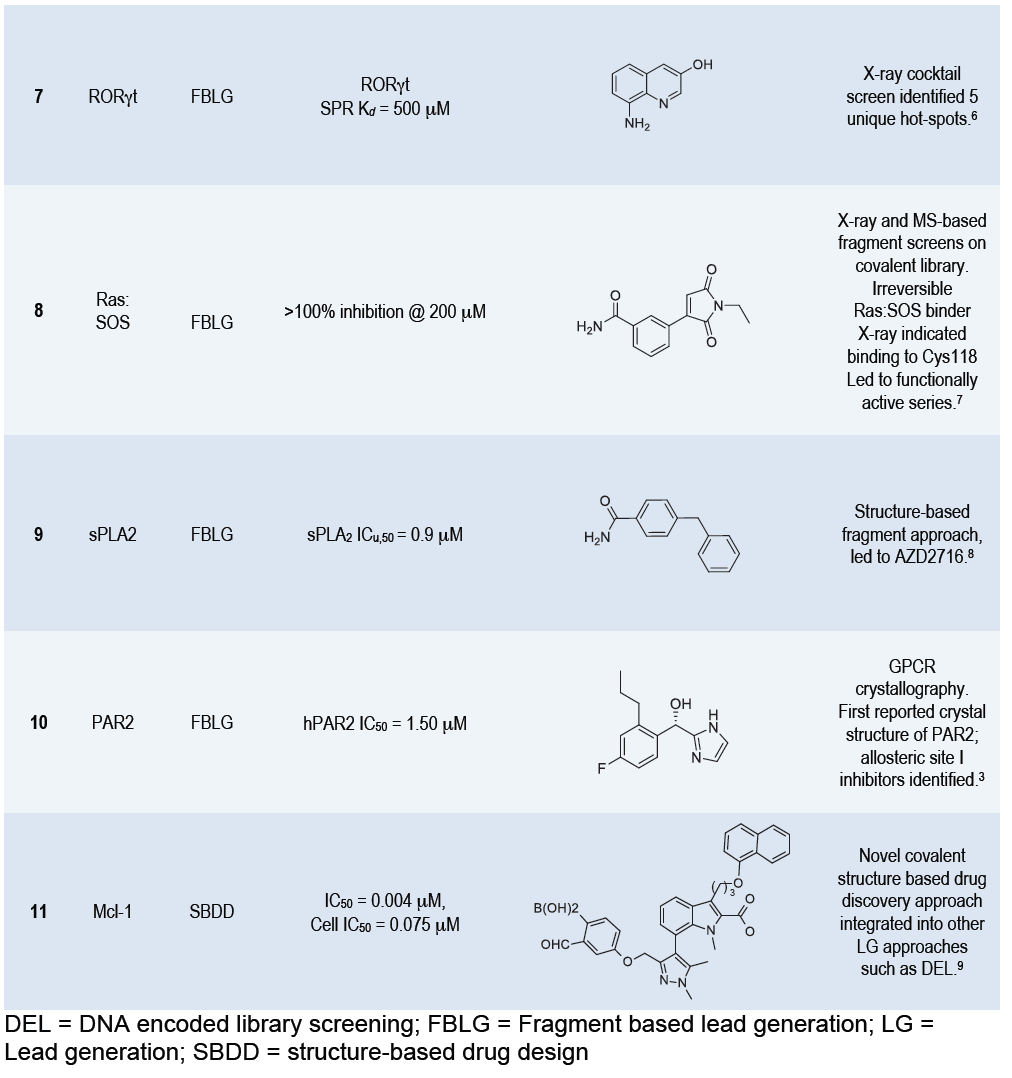
除了应用HTS,其他技术也被广泛应用,如DNA编码文库筛选(DNA-encoded library screening,DEL)、基于片段的先导化合物设计(fragment-based lead generation,FBLG)、基于结构的先导药物设计(structure-based drug design,SBDD)等。关键是采用多种方法并行筛选,而非选择仅选择一个系列,便于尽可能挑选到更好的先导化合物。如在筛选PAR2(protease-activated receptor 2)抑制剂的时候,AZ与Heptares Therapeutics合作构建了热稳定的受体,通过生理物理学片段药物筛选方法得到有效的且有选择性的别构抑制剂(Entry 10),同时用DEL方法发现了另外一个可结合的位点(Entry 4)。
5R方法的引入确实提升研发的成功率,缩短了研发周期,也降低了研发早期课题失败的比例。但对于高难度靶点的研究还需进一步优化药物设计的方法,比如2014年Cox和他的同事们阐述了针对GTPase KRAS靶点药物设计的难度[8]。早在1982年人们在癌细胞中发现突变型、组成型活化的RAS基因,也是人们首次这类疾病中发现基因的突变,陆续人们发现癌细胞中存在>500种突变的基因,而RAS基因(HRAS, NRAS 和 KRAS)所占比率最高。经过三十多年的努力,人们依旧没有发现有效的靶向RAS蛋白的药物,一度让人们以为她可能不是一个可成药的靶点。近几年的研究人们发现了能共价结合G12C突变的抑制剂,后续反义寡聚核苷酸、特异于KRAS的疫苗、PROTACs等新方法或许能提供一些解决办法。
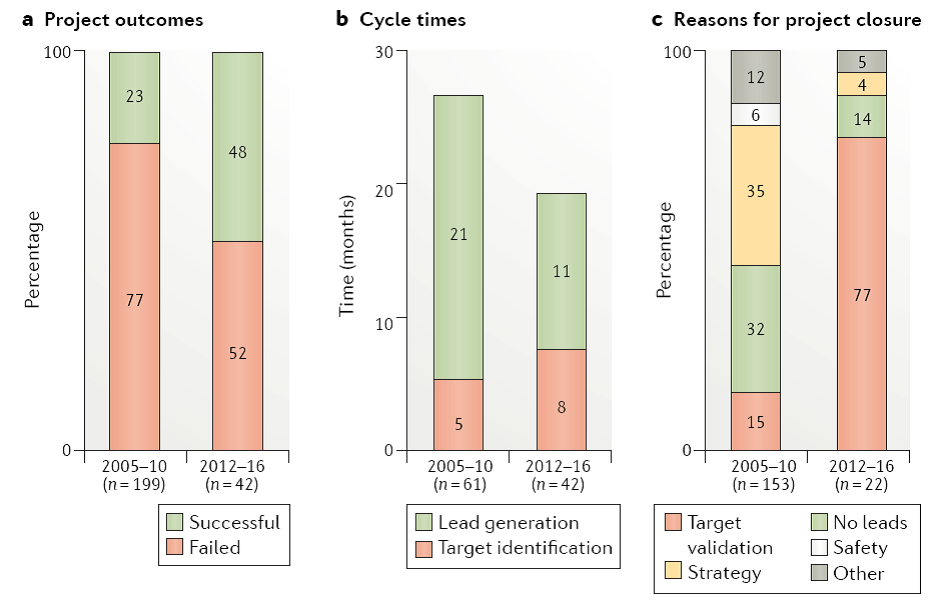
近年来越来越多的项目在靶点验证阶段被叫停,主要由于临床前的研究手段更加多样、直接,基因编辑、基因组学、人源化动物模型的开发也提高了人们验证靶点的准确率,降低成本。选择一个正确的靶点在5R框架中是非常重要的,也是在药物研发领域里最为重要的一个选择。即使具有高选择性、高质量的小分子,没有遇到正确的靶点也不会成为药物。
选择正确的组织
在临床前通常会观测一个关键的参数来提升项目的成功率——靶向结合(target engagement)或机制验证(Proof of mechanism, POM),一般评价在人体内可预测、可定量的条件下候选药物和靶点间的相互作用,间接反应功能效应。加强对任何一个分子的PK, PK/PD和ADME属性的理解,对先导化合物和临床候选化合物的选择很关键,也可辅助人们更有针对性的设计临床试验。前不久Genentech的 Dr. Cornelis Marcel Hop在公司内介绍了几个案例,突出介绍了DMPK在药物研发中的关键作用。加强AMDE和PK属性的测试,从二十年前狭隘的高通量筛选,到如今更全面、以基于模型分析的方式整合入对人体内PK/PD和有效剂量的预测,发生了质的转变,如今更是被用来指导药物的设计、改进、和候选药物的筛选、人体内PK/PD模型和有效剂量的预测,已远远超出单单分析药物自身PK特性的研究范围。
如今临床前模型的预测的影响力已在临床试验中得到证实,相对较差的PK或 PK/PD将导致人们对剂量、给药方案的调整,甚至直接影响项目是否该被叫停。但是有一些预测和实际间差别较大的情况依然发生,若发现五倍以上的差异,建议再次深入研究具体分子机理,可能有意外的发现。在2012-2016年期间AZ的两个项目的数据显示目前的临床前模型依然还有很大的提升空间。一个是ER的SERD,AZD9496[9, 10],在临床前发现她的half-life有6 h,而临床试验中进观测到 1-2 h,间接显示了二者测得的清除率的不同。后来发现体外与蛋白的结合率的差异,会导致清除率预测产生偏差,而扩散体积较小会放大这一步的影响,后续改进的模型可对代谢相对缓慢化合物进行分析。[11]另一个案例是PIM激酶的小分子抑制剂,AZD1208,实验结果显示该分子的PK特性很差,于此同时却发现一个新的机制可诱导CYP3A。对该化合物的临床前的研究表明人体内CYP3A介导的代谢占主要部分,而在通常标准的CYP诱导方法中,如HepaRG和肝细胞,并未看到可诱导的迹象。在临床前的PK和单剂量临床试验中,该化合物显现出剂量相关的暴露量,half-life>30 h,而在多剂量试验中,暴露量随着时间的延长和剂量的减少而下降。早期的分析显示这是一种新的、有别于传统的CYP诱导方式和机理。
在改进化合物PK特性的同时,也需了解“正确组织”中的PK/PD特征、药物暴露量和靶点的关系、以及下游的生物学功能效应。近年来PD标记分子的分析可以更好的帮助人们预测给药强度、时长耐受剂量,辅助人们决定项目是否能继续向前推进临床试验。一般而言,试验中的POM可分析小分子是否有充分PK暴露量及相对安全的剂量范围与靶点相互作用。
在靶向TLR的药物设计中AZ发现了AZD8848(TLR7激动剂)和AZD1419(TLR9激动剂),临床试验中分析干扰素通路活化实验时人们分析了二者对CXCL10均有2.5倍左右的上调能力,表明二者均可与靶点充分的结合并表现出阳性POM。然而AZD8848却同时表现出剂量非依赖的副作用,如中强度流感征状,相比而言AZD1419只有在高剂量时表现出副作用,且有一定的剂量依赖性。面对如此结果,人们只推进AZD1419的临床试验而停止了另一个。
正确理解安全性
对临床安全性的评估需要慎之又慎,要求人们认证分析临床前体内和体外的综合结果来预测临床试验的风险。针对靶点的特殊功能,可以设计多种试验、模型,尽量在临床前充分搜集可能的风险信息。小分子在设计先导化合物阶段需要反复进行in silico和in vitro的安全性试验评估药物在器官中的效应,如今已有多种人源的模型,如肝的3D微培养、人源iPSC诱导的心肌细胞的应用可在早期评估化合物对肝和心肌的安评,二者也是临床上常见的因安全性不够而导致项目失败的两个方面。
在项目接近候选化合物的选择时,会在多种属内进行体内和体外实验评价化合物的特性,结果可能一致、也可能各不相同,需要综合比较分析。BRD4的抑制剂AZD5153在早期安评测试的时候发现在体外肠道样器官内表现出毒性,在亚治疗剂量的情况下在狗体内表现出急性的毒性,体外培养肠道肝细胞3D类器官(迷你肠道)发现该化合物在狗内较为敏感,而在人样器官中的结果却最不敏感。相比而言,BRD4竞争性抑制剂OTX015却表现出较为敏感的剂量,在临床上的结果也显示后者的暴露量相比可高出四倍之多。
选择正确的病人
在精准医疗盛行的背景下,需要对症试验。进入临床试验前需要对筛选的人选进行分析,随之也开发了许多标记分子的检测方法。在临床早期,针对药物靶点的单一基因的生物标记分子分析已被广泛使用,如对PD1或PD-L1分子表达水平的检测,随之而生的也有许多高效、准确的诊断试剂盒。NSCLC的一线疗法中,有数据显示Pembrolizumab更适合于PDL1表达高于50%的患者。
临床上也经常发现耐药株的突变产生,药物的选择也需要参考病人肿瘤样本中特定基因的突变型,比如AKT1和PIK3CA突变时可选用AKT的抑制剂(AZD5653,MK-2206)、PI3K抑制剂(Genentech的GDC0941、Novartis的BYL719)等。基因的拷贝数和扩增也常用于临床的诊断,比如对原癌基因络氨酸激酶受体MET的分析常用于选择MET的抑制剂,比如用于治疗乳头状肾细胞癌和NSCLC的Onartuzumab、Savolitinib或Capmatinib等药物。
恰当的商业定位
早期的药物研发主要取决于商业定位,在2005-2010年间,AZ的项目推荐主要参考其药物在商业上的自信,而并不是科学上的自信,最终许多项目不告而终。如今候选化合物的选择不再主要关注商业价值,而是更关心药物本身的安全性和疗效,主要是能够研制出升级版的药物。该过程中,药物的研发还处于早期,距离上市还有很长的一段时间,在此期间科学地关注药物自身的属性,并非由市场来主导做出选择。当即将进入临床III期调查时,需要有专业的团队综合分析该药物的商业潜力,该如何推进后续工作,如商业评估、试用人群、未及的医疗需求,个性需求和标、法、全球的报销体系、销售预测等等,该过程还需要适应当前的市场前景及周边的环境,是一项综合的、复杂而专业的评估,对后续药物的商业分析很重要。
后记
随着课题的深入,渐渐的发现药物研发路之奇险,其中剧情跌宕起伏,收官之际却是几多欢喜几多愁。为人类作出巨大贡献的同时伴有丰厚的经济收入,研发的过程吸引着无数英才投身于此。看着国际上的Big Pharma引领各类药物研发数十年,有着沉甸甸的经验积累和丰硕的成功案例,真心希望日后的新兴舞台上有更多中国药企的身影!希望本土的企业能够研制出世界一流的药物!
十年后,会是什么情景?
TJ
2018年5月2日 星期三
1. Morgan, P., et al., Impact of a five-dimensional framework on R&D productivity at AstraZeneca. Nat Rev Drug Discov, 2018. 17(3): p. 167-181.
2. Kola, I. and J. Landis, Can the pharmaceutical industry reduce attrition rates? Nat Rev Drug Discov, 2004. 3(8): p. 711-5.
3. Martinez Molina, D., et al., Monitoring drug target engagement in cells and tissues using the cellular thermal shift assay. Science, 2013. 341(6141): p. 84-7.
4. Dewey, F.E., et al., Genetic and Pharmacologic Inactivation of ANGPTL3 and Cardiovascular Disease. N Engl J Med, 2017. 377(3): p. 211-221.
5. Bray, M.A., et al., Workflow and metrics for image quality control in large-scale high-content screens. J Biomol Screen, 2012. 17(2): p. 266-74.
6. Edwards, B.S. and L.A. Sklar, Flow Cytometry: Impact on Early Drug Discovery. J Biomol Screen, 2015. 20(6): p. 689-707.
7. Mullard, A., European lead factory opens for business. Nat Rev Drug Discov, 2013. 12(3): p. 173-5.
8. Cox, A.D., et al., Drugging the undruggable RAS: Mission possible? Nat Rev Drug Discov, 2014. 13(11): p. 828-51.
9. Weir, H.M., et al., AZD9496: An Oral Estrogen Receptor Inhibitor That Blocks the Growth of ER-Positive and ESR1-Mutant Breast Tumors in Preclinical Models. Cancer Res, 2016. 76(11): p. 3307-18.
10. De Savi, C., et al., Optimization of a Novel Binding Motif to (E)-3-(3,5-Difluoro-4-((1R,3R)-2-(2-fluoro-2-methylpropyl)-3-methyl-2,3,4,9-tetra hydro-1H-pyrido[3,4-b]indol-1-yl)phenyl)acrylic Acid (AZD9496), a Potent and Orally Bioavailable Selective Estrogen Receptor Downregulator and Antagonist. J Med Chem, 2015. 58(20): p. 8128-40.
11. Hultman, I., et al., Use of HmuREL Human Coculture System for Prediction of Intrinsic Clearance and Metabolite Formation for Slowly Metabolized Compounds. Mol Pharm, 2016. 13(8): p. 2796-807.
https://wap.sciencenet.cn/blog-571539-1112047.html
上一篇:加班?不加班?
下一篇:The biology and management of NSCLC