博文
表观遗传的奥秘丨父亲的生活习惯也会影响胎儿?
|||

图片来源丨Stockvault,by Jack Moreh
表观遗传研究领域的一个重要而有趣的问题是:表观遗传信息能否像 DNA 序列一样,从父母传递到下一代呢?
为了回答这个问题,让我们先从两性生殖说起。
我们知道,人类的出生需要父母的遗传物质结合。我们享受着双亲无微不至的照顾,在他们的悉心呵护下茁壮成长。但是,一个很有意思的问题是,为何包括人类在内的很多高等生物,必须通过父母有性生殖才能产生后代?
两性生殖的奥秘
DNA 甲基化介导的表观遗传信息的遗传及重编程
为了探索上述问题,早在 20 世纪 80 年代,科学家们就进行了一项有趣的实验。在自然条件下,两只雄性小鼠或两只雌性小鼠是无法通过正常受精产生后代的。科学家通过显微操作,将受精卵中雄(雌)原核置换成来自另外一个细胞的雌(雄)原核,这样人工制造形成具有两套母本基因组或两套父本基因组的“受精卵”,科学家们称之为孤雌或孤雄胚胎(图1)。检测发现,这种“单亲”胚胎是不能正常发育成小鼠的,而只有那些同时具有双亲细胞核的胚胎才可以正常出生。当胚胎发育一段时间后,科学家们发现,正常胚胎中一部分细胞会分化为胚胎外部的营养和支持组织(胚外组织,如一些细胞后续会发育成提供营养的胎盘),另一部分细胞则将分化为胚胎个体本身(胚内组织)。相反,孤雄生殖的胚胎中细胞更多地发育为胚外组织;而孤雌胚胎中的细胞则恰恰相反,会更多地向胚内组织发育。因此仅仅具有单亲基因组的胚胎无法正常发育成为完整的个体。
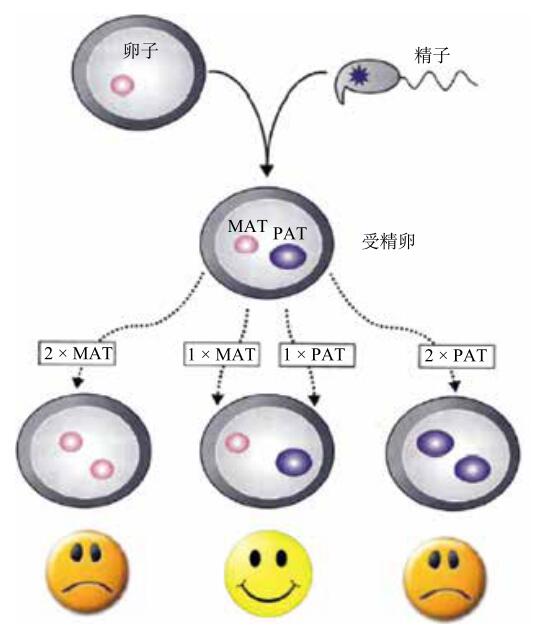
图1 孤雌及孤雄生殖示意图
注:MAT 为母本基因组;PAT 为父本基因组。
从这些尝试中科学家们发现,无论是母本还是父本基因组,似乎都带有某些该亲本所特有的信息,而这些信息是子代胚胎发育所必需的。进一步的实验表明,这些信息似乎不是来源于 DNA 遗传序列的差别,因为科学家可以用父本和母本 DNA 序列几乎完全相同的小鼠进行以上实验,但是拥有两套母本或父本基因组的小鼠仍然不能正常发育和出生。这表明,父母双方的差别不仅在于 DNA 遗传序列方面,也包括 DNA 序列之外的一些信息。这些和 DNA 序列本身无关,但是可以遗传给子代的信息被称为表观遗传信息。缺失父母任何一方的表观遗传信息,胚胎都无法正常发育。

图片来源丨Pexels
随着研究越来越深入,科学家们发现这些异常发育的胚胎中有一些基因,其来源于父本和母本的表达有很大差别。比如,H19 基因可以控制胚胎大小及细胞生长。它的异常表达不仅导致胚胎发育异常,还可能引发某些癌症的发生。这个基因的特点是在正常发育的胚胎中,来自于母亲的基因拷贝表达,而来自于父亲的基因拷贝不表达。如果有两个母本的拷贝,H19 就会过量表达;而如果有两个父本的拷贝,H19 表达量就会太低(图2)。这种亲本间基因表达差别是由于调控该基因表达的 DNA 序列上甲基化程度存在差异。这种来源于不同亲本的 DNA 序列有差异甲基化的现象被称为基因组印记(genomic imprinting)。
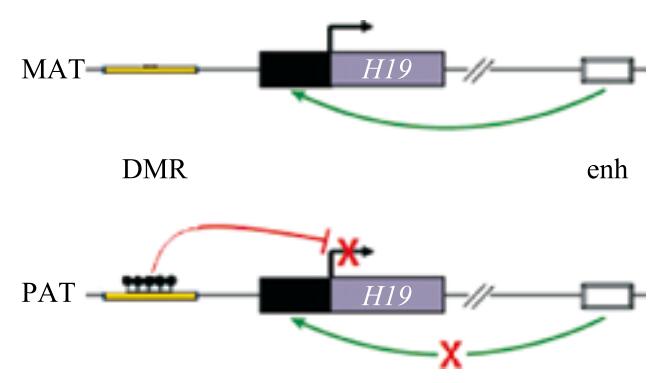
图2 印记基因 H19 调控表达机制
DMR 为 Differentially Methylated Region,差异甲基化区域;enh 为 enhancer,即增强子,可调控基因表达,是提高基因转录水平的基因组DNA 元件;MAT 为母本基因组;PAT 为父本基因组。其中差异甲基化区域(DMR)在母本基因组中保持低甲基化,因而能够“招募”一类绝缘子蛋白——CTCF 蛋白,结合到该区域,从而促使该增强子与 H19 基因发生相互作用,增强 H19 在母本基因组的表达;而在父本基因组上,该区域甲基化水平较高,导致 CTCF 蛋白无法结合到该区域,使得增强子无法与 H19 基因联系,抑制了 H19 基因的表达。
由此可见,DNA 甲基化对基因组印记的形成非常重要。那么何为DNA 甲基化呢?
DNA 甲基化是指在 DNA 甲 基 转 移 酶 的 作 用 下, 将 供 体 上 甲 基(CH₃)基团转移至胞嘧啶(C)的 5′碳原子上,形成甲基化胞嘧啶的过程。在哺乳动物体内,该反应主要发生在基因组序列 CpG 位点上。一般来说,启动子区域甲基化水平与基因表达水平呈现负相关。启动子区高甲基化与基因沉默相关;相反,基因表达通常伴随着启动子区甲基化的降低或缺失。DNA 甲基化的建立主要依赖于 DNA 甲基转移酶 DNMT家 族。 该家 族 蛋 白 能 通 过 S-腺 苷 甲 硫 氨 酸(S-adenosyl-methionine, SAM)提供的甲基来修饰胞嘧啶。DNMT 蛋白家族主要包括 DNMT1、DNMT2、DNMT3A、DNMT3B 和 DNMT3L 五个成员。最新研究发现了一种新的 DNA 甲基转移酶,被命名为 DNMT3C。而 DNA 去甲基化的机制比较复杂,其中被广泛研究的主要是氧化去甲基化过程中的 TET(ten-eleven translocation) 蛋 白 家 族, 包 括 TET1,TET2 及 TET3。TET蛋白是一种依赖于 α-酮戊二酸及二价铁离子的双加氧酶,通过氧化催化5-甲基胞嘧啶(5mC)转化为 5-羟甲基胞嘧啶(5hmC),并最终被未被修饰的胞嘧啶替代,从而实现甲基化主动去除。
DNA 甲基化是生物体内最重要的表观遗传标记之一,既参与调控基因转录、维持染色体结构,也在基因印记、X 染色体失活等方面发挥重要作用。DNA 甲基化异常也是导致癌症发生的原因之一,因此,维持体内的甲基化水平正常对生物体生长发育十分重要。
基因印记主要指在配子形成过程中,针对某些特别的基因,父本和母本携带不同的表观遗传修饰,导致受精后在胚胎发育过程中不同亲本来源的两个等位基因在子代细胞中差异化表达。当印记基因在亲代和子代的传递过程中发生障碍时,这些基因就会发生表达失调,最终导致胚胎发育异常。
在了解到印记基因的原理及其功能后,科学家们大胆设想:如果能够人为干预亲代遗传物质上的印记基因,使两套同样亲本(父本或母本)基因组带有正常双亲所具有的印记信息,那么是否可以通过同性生殖产生正常后代呢?经过不懈的努力,他们成功地实现了这个听上去有些匪夷所思的设想。日本科学家通过对两种印记基因 H19 及 Dlk1 进行基因编辑,使其表达水平与正常胚胎相近,从而得到了仅有母本基因组的小鼠胚胎。而该实验也证实了,基因印记是决定胚胎发育成功与否最主要的关卡之一。
印记基因不仅在胚胎发育过程中发挥重要作用。在临床研究中,印记基因的异常表达也是导致很多遗传疾病的原因之一。
Prader-Willi 综 合 征(Prader-Willi syndrome, PWS) 和 Angelman 综合征(Angelman syndrome, AS)是两种临床表征差异很大的神经遗传性疾病。Prader-Willi 综合征患者表现为身材肥胖、矮小,有智力障碍,手足异常,促性腺激素分泌不足。Angelman 综合征患者表现为智力低下,出现癫痫的情况,语言、运动障碍,面容特征为下颌巨大、张口吐舌(图3)。虽然两种疾病的表征差异很大,但是它们都是由同一染色体区段(15q11-13)缺陷所引起的。不同的是,PWS 是父本染色体 15 号染色体存在缺陷,而 AS 则为母本染色体同一区段存在缺陷。PWS 和 AS的致病机理之一就是该区段的 DNA 缺失及 DNA 甲基化异常。例如,在PWS 患者的父本染色体上发现了母本特有的甲基化印迹,而 AS 患者则相反,从而导致相关印记基因表达异常。事实上,目前所发现的印记基因大多与胎儿的生长发育或其他疾病相关,并且它们的调控很多都和DNA 甲基化紧密相连。

图3 Angelman 综合征(a)和 Prader-Willi 综合征(b)的临床特征
上述例子证明,父母的基因印记确实对生殖发育至关重要。然而,在形成下一代卵子和精子的过程中,细胞要从原始生殖细胞(primordial germ cell, PGC,指精子和卵子的前体细胞)经过减数分裂形成单倍体的配子,这时候父母的染色体会随机分配到配子中。比如,新形成的卵子中的基因印记就会有两种可能,一种是来源于母亲的,而另一种是来源于父亲的。这样有一半的卵子就会载有错误的基因印记。精子也会出现相同的问题。那么生物体是如何保证卵子和精子仍然能保持印记的正确和稳定呢?这里面的秘密其实在于基因印记经历了一次重建的过程。基因印记在原始生殖细胞形成和成熟的过程中需要被擦除,而新的基因印记则在卵子和精子的发育过程中重新建立起来。这样就能保证精子和卵子中的基因印记总是被正确地建立并遗传给下一代。
实际上,在基因印记被擦除的同时,整个基因组的 DNA 甲基化也几乎被除掉了。哺乳动物胚胎发育周期中会发生两次全基因组范围内 DNA甲基化的去除与建立。其中一次是原始生殖细胞形成的过程中,全基因组甲基化被基本去除(仅剩余 7%~14%)。
甲基化重编程的过程对哺乳动物的发育十分重要。当科学家们将去甲基化酶 TET 敲除后,基因印记将无法正常去除,导致后代发育出现多种发育缺陷或致死的情况。另一次全基因组的去甲基化是从精子与卵细胞结合形成受精卵开始,一直持续到胚胎在子宫着床前后,但印记基因甲基化状态此时基本保持不变。
综上所述,印记基因在不同世代中经历了往复循环(图4),在配子形成过程中形成亲本特异的印记。受精后,胚胎维持配子携带的亲本印记至囊胚及其分化形成的各类体细胞中。在原始生殖细胞发育阶段,亲本的印记信息被擦除,而在后续配子发育成熟过程中,性别特异的印记信息被重新建立并进入下一个循环。该循环过程对于哺乳动物发育至关重要。

图4 印记基因世代传递
印记基因在世代传递过程中呈现动态变化,包括在配子形成过程中形成亲本特异印记的阶段、在体细胞中维持并发挥作用的阶段,以及在生殖细胞发育过程中印记被擦除后重新建立的阶段。受精后,胚胎维持配子携带的亲本印记至囊胚及其分化发育的各类体细胞中,且正常发挥功能。在原始生殖细胞发育阶段,亲本的印记信息被擦除,而在后续配子发育成熟过程中,性别特异印记信息被重新建立并进入下一个循环。
父亲的生活习惯也会影响胎儿吗?
表观遗传信息的代际间传递不光可以通过 DNA 甲基化的方式,还可以通过一些非编码 RNA。有趣的是,近年来的研究表明,不光是母亲的生活习惯对胎儿有影响,父亲的生活习惯也会影响到下一代。

图片来源丨Pexels
比如,在小鼠实验中,如果给雄鼠喂食高脂肪食物,其下一代会出现代谢功能异常的现象。进一步研究发现,高脂肪饮食会使得父亲精子中的 tsRNA(tRNA-derived small RNAs,一类特殊的 RNA)发生表达和修饰上的改变,而当这些发生变化的 tsRNA 进入受精卵后,子代小鼠代谢将出现紊乱,并且许多与代谢相关的基因表达量显著减少(图 5)。另一项同时期的研究发现,父亲低蛋白的饮食会影响附睾中成熟精子携带的 tRNA(转运 RNA)片段,这些 tRNA 片段会抑制部分胚胎基因表达,从而影响细胞的全能性。这两项研究都揭示了亲代不健康的饮食习惯可能通过表观遗传机制对后代产生不良影响。

图5 高脂肪饮食通过改变父亲的 tsRNA 影响子代的代谢功能
图中分别使用正常饮食和高脂肪饮食雄性小鼠的精子与正常雌性小鼠卵细胞受精,子代特征显示高脂肪饮食的后代呈现出代谢功能异常。HFD 为 high-fat diet,高脂肪饮食,含有 60%脂肪;ND 指 normal diet,正常饮食,只含有 10% 脂肪。
综上所述,一些表观遗传信息能够由亲本遗传至下一代,并且对子代的存活、发育具有非常重要的影响;而其他一些亲本表观遗传信息在世代传递过程中则需要被消除,随后重建子代表观遗传信息。
正是这种精密的表观遗传和重编程,给予了我们和父母一脉相承却又各具特色的人生起点,造就了缤纷斑斓的新生命。

本文摘编自曹晓风,许瑞明主编《承续的魅力:令人着迷的表观遗传学》第一章第二节部分内容,略有删减改动。
主编:曹晓风,许瑞明
责任编辑:王亚萍
北京:科学出版社,2018.11
ISBN:978-7-03-059640-6
近二十年来,表观遗传的研究正如火如荼地开展,研究内容涵盖了从动物、植物到真菌,从干细胞、胚胎发育到衰老、癌症发生等生命科学研究的方方面面。那么什么是表观遗传,为什么它的研究占据了生命科学研究的重要地位呢?本书邀请了我国表观遗传领域的十余位优秀科学家对各自的研究方向进行了介绍。
本期编辑丨小文
一起阅读科学!
科学出版社│微信ID:sciencepress-cspm
专业品质 学术价值
原创好读 科学品味
更多好素材,期待您的来稿
https://wap.sciencenet.cn/blog-528739-1170164.html
上一篇:浅谈二维过渡金属硫族化合物的晶相工程
下一篇:聚焦材料与能源技术丨高技术发展综述(下)
