博文
说说电池(二)
 精选
精选
||
前年写的博文《说说电池(一)》意外地得到了许多网友的关注。虽然有的朋友指出我一些地方说的不当,但仍发现一点是:这个话题毕竟引起了广泛的兴趣。这里要感谢那些对我的博文提出指正的朋友。我的目的是希望用浅显易懂的语言,向大众介绍电池的工作原理。在本期中我们来具体讨论一下锂离子电池的工作原理。错过了首期的朋友仍可点击这里阅读上一篇博文。提醒大家的是:从本期开始,我们的介绍会比第一期深入得多,您可要坐稳了慢慢看。
小小复习
先最简要地复习一下第一期的中心思想。电化学反应就是把氧化还原反应中的氧化剂与还原剂在物理上隔离,这样发生反应的同时必然有电子流过外电路。原电池是一种电化学系统,有两个电极:放电时一个只发生氧化反应,称为阳极或者负极,另一个只发生还原反应,称为阴极或者正极。
用现实社会来类比电池的工作原理:电池为什么能放出电流来
在进入具体的化学原理之前,我们不妨满足一下急性子的读者,就是迅速地“理解”以下两个核心问题:
(1) 电池凭什么能自发放出电流来?
(2) 燃烧甲醇驱动热机(化学反应),与甲醇燃料电池(电化学反应)相比,为什么后者的能量利用效率要高得多?电化学有什么魔力实现这一点呢?
要理解这两个问题其实并不难。先小小挑战一下读者:现实社会中,绝大多数人都是用劳动来换取金钱,但为什么有人可以用钱来赚钱呢?为什么绝大多数国家都有银行的存在呢?如果您理解了这点,也就可以理解电化学的奥妙。
我们不妨把电子比作货币,同带负电的阴离子比作货物。阳离子由于所带的电荷与货币相反,就只好委屈一下,比作某种具有负价值的东西,例如辐射性的核废料。现实社会存在商品交易,其原则就是公平原则。化学中有反应,其原则我们这里定为电中性原则。这个也好理解,因为在我们的比喻中凡是带负电的都是“好的”而凡是带正电的都是“坏的”。要破坏电中性就好比在贸易中欺诈一样。下面我们看看化学(非电化学)里的置换反应是怎样一种情况。湿法炼铜的反应:其中铁跟铜是一手交钱,一手交货。铁付钱(电子)给铜,而铜把货物(硫酸根)交给铁。

如果现实社会中所有的贸易都是一手交钱,一手交货的话,那么投资,金融业,银行的重要性就要大打折扣了。实际状况却不是这样,因为现代社会的金融体系大行其道,其中必有深层次的原因。
好,我们已经可以做如下认定:纯化学里的氧化还原反应好像一手交钱,一手交货的原始贸易。而电化学反应就好比现代社会的运行方式:钱经过银行中转,货通过运输系统(比如铁路)中转。下面我们将证明:电池中的电解液就好比连接生产者和消费者的运输通道,而外电路就是银行(如下图所示)。
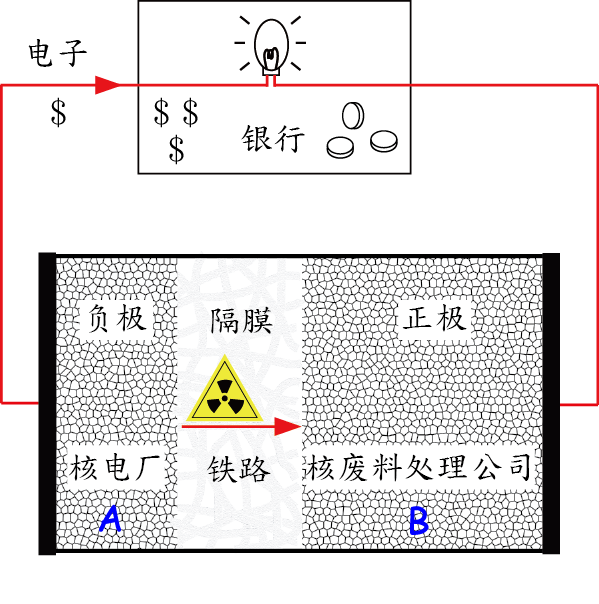
电路理论里面有个最基本的基尔霍夫定律,它要求了有多少电子从电池的负极流出,也就有多少电子从电池的正极流入。对于外电路而言,也是多少电子入,就有多少电子出。既然储户存入银行多少钱,还至少可以取回多少钱,那银行凭什么可以经营下去呢?这里就涉及到钱的时效性问题。储户存钱在先,提钱在后,这其中的时间差,银行用现金就可以做很多事。现金对很多人或者企业是很重要的。如果有人开发出一种高效的太阳能热水器技术,可望有极好的市场收益,但没有现金去建厂。这时他就可能去找风险投资者,说你现在先给我投多少钱,等厂子建好了,产品卖出去以后我加倍付钱给你。投资者投了钱,厂子建好了,产品卖出去了,就加倍把投的钱收回来。试问:这个过程是否违背了公平原则?非也。对于持有技术的人而言,现在一百万现金的价值远大于将来两百万现金的价值。对于投资者而言,金钱的时效性却没有那么急迫,他们关心的是拥有金钱的总量。所以在市场交易公平原则的前提下,双方自愿完成了交易(自愿交易对应于自发放电)。好,既然金钱有时效性,我们就把这个时效性比作电子的电化学势,你也可以理解为电子的能量。由此可见,银行(外电路)从电池负极接受的是高时效性的金钱(能量高的电子),返还给电池正极的却是低时效性的金钱(能量低的电子),所以银行就大有可为了(外电路可以利用电子的这个能量差做很多事情,比如驱动灯泡或者电暖器)。
但是且慢,外电路(银行)是从中受益了,可是电池呢?为什么电池能自发地提供高能量的电子,却甘愿收回低能量的电子呢?这岂不是自我受损,违背了商品交易规则?唯一的解释是:其实电池也从中受益了。这就是理解电池为什么能放电的关键所在。
要理解这一点,我们以一个假想的电池为例(如下图)。

假定电池负极是锂片,发生的反应是
![]()
由于带正电的锂离子我们比作核废料,那么这个负极就可以理解为某核电厂 A。该厂的核心技术都在于如何高效用核能发电,却无力回收或者处理核废料。怎么办呢?他们把核废料回收的工作外包给公司 B,就是某个专业处理核废料的公司。公司 B 就是电池的正极,假定是二氧化钴 CoO2(这种东西并不存在,但不妨暂且容忍它存在)。CoO2 是一个很有问题的东西,因为钴元素一般只有 +2 和 +3 价,其中 +3 价已经是有相当的氧化性了。如果整出 +4 价的钴出来,它一定是对电子十分饥渴,想要变回正常的 +3 价。这说明公司 B 希望扩大业务,想要接单子,通过劳动赚钱。
现在电厂 A 和公司 B 一拍即合。A 去银行把钱打到 B 的账户上,同时用铁路把核废料运输到 B 处。这就完成了电池的放电过程:负极把电子输送给外电路,同时也把锂离子从电池内部通过电解液运输给正极。
我们来分析一下负极 A 和正极 B 的得失。
负极材料是锂,其实是由锂离子与等量的电子由金属键结合而成。这就好比电厂 A 既有核废料,又有钱。电厂 A 先付钱给银行,而 B 之后才能拿到钱,所以 A 付出的是时效性最高的金钱,因为是现金。但 A 仍然愿意这样做,因为 A 更关心的是核废料(锂离子)如何处理掉,至于现金则不在考虑之列,因为 A 自可以通过正常经营电力来赚钱。通过这场交易,A 最大的目的达到了,也就是了成功清理了核废料。A 对银行没有不满,因为在核废料处理的事情上,A 不仅不在乎钱的时效性,甚至也不太在乎花钱。
正极 B 呢?假设 CoO2 平均每个分子式吸收了一个锂离子和一个电子,则变成钴酸锂 LiCoO2。核废料来了,钱也来了,B 是否满意呢?答案是肯定的。B 是专业处理核废料的,接受了锂离子它并不怕。关键是 +4 价的钴的困境得以缓解,得到了想要的电子。B 对银行是否有不满呢?非也。因为 B 其实最关心的是它有多少钱,而不一定在乎有多少现金(普通老百姓的想法基本也是这样)。B 并不是投资银行,而是一个出售服务的公司。只要能扩大业务,它就会满意。
看来,A,B 和银行都满意了。那么,银行的存在对于 A 和 B 的交易是否为必需的呢?答案是否定的。如果 A 和 B 物理上不是隔离的,假如在同一个城市,那么也可能 A 和 B 同时同地完成金钱和核废料的交付,却没有养活银行。这就是普通的氧化还原反应,比如湿法炼铜的反应。银行之所以能存在,是因为有资金流动,否则它必然倒闭。电池之所以能放出电来,是因为正极和负极被隔离了,所以电子流经了外电路,点亮了灯泡。
电池放电是一个自发的过程,就好比现实社会的商品交易也是自愿的。但是,金钱经由银行就繁荣了金融业,而银行可以利用资金的流动来获得很多利益。如果所有的交易都是一手交钱,一手交货,银行就没多少位置了。但是,电化学反应就好像引入了金融系统的现代贸易,它寻求的是把金钱分配到最需要的地方去,从而获利。
电池的奥秘就在于负极材料跟正极材料各有不同的需求(一个更关心使用货物,一个更关心赚钱),而人们巧妙地将其配对。即使外电路有电阻,它们也愿意彼此满足这种需求,从而驱动了外电路,灯泡就亮了!好比一旦有资金流动,银行就活了!银行何尝不是也利用了生产者和消费者的差异呢!至于甲醇燃料电池比直接烧甲醇的效率高,也情同此理。尽管金融业的贪婪可以导致经济危机,但现代社会的确也需要金融业,因为有效分配资金可以提高社会的效率。
最后,我们也不要忽视了运输系统(电解液)的重要性。如果没有电解液提供锂离子传输通道的话,就好比公司 A 付了钱,却无法将核废料处理出去。由于公平原则(电中性原则),A 必然要把钱要回来,所以若内部没有离子传输的通道的话,电池也就放不出电来。
电位对氧化和还原反应的影响:电池为什么有电压
我们现在言归正传,开始进入严肃一点的科学。之前的类比请不要 take it too seriously,虽然以后我们还会不定时回顾这个类比。
在《说说电池(一)》中我们已经提到,金属锂是电位最负的电极。严格说,我们指的是 Li/Li+ 这个反应对。
电位对氧化还原反应是有很大影响的。低电位是终极的还原剂,而高电位是终极的氧化剂。比如高锰酸钾是一种强氧化剂,所以只有更强的氧化剂才能把锰酸钾(+6 价锰)氧化为高锰酸钾(+7 价锰),而这样的氧化剂是难寻的。然而,在高电位面前,即使锰酸钾只得乖乖就擒,交出电子来。同样地,再强的还原剂,例如碱金属,也可以通过低电位,从其盐中还原出来。
从另一个角度来看,这个结论似乎又是惊人的。例如还是以下的反应:
![]()
反应左侧是中性的锂,而右侧既有带正电的锂离子,又有带负电的电子。按照我们上面的结论,当电位降低的时候,平衡将会左移,即发生锂离子被还原为锂的净反应。可是,电位降低的时候,貌似电子能量升高但锂离子能量降低,等式右侧的总能量似乎不应该发生变化才对。
要明白这个问题,就需要懂得等式右侧的锂离子和电子在空间上是分开的,并理解电化学双电层的概念。
我们所说的电极电位,是指固相也就是金属相的电位,而不是电解液的电位。电解液或者说电解质的定义,是可以传导离子,但却对电子绝缘的媒体。如果电解液对电子不绝缘的话,电池的电早就会漏没了。对于一个绝缘体而言,是无法直接测量其电位的,因为这必然涉及到用某个导体电极插入其里面,结果测出来的还是固相导体的电位。当把锂片插入到极稀的 LiPF6 的碳酸酯类(例如碳酸丙烯酯 PC)有机溶液里时,根据直觉推测(因为浓度极稀),部分锂应该发生溶解,生成溶液中的锂离子,并在锂电极上残留带负电的电子,因为电子无法进入到电解液里。可是这样一来,电荷就发生了分离。随着溶解的锂越来越多,锂电极就带了越来越多的负电,而电解液则带越来越多的正电。溶液部分锂离子由于静电吸引作用,又会跑回锂片中与电子重新结合。长此以往,总会到这样一个地步,就是电荷分离到了如此强的程度,以至于溶解速率等于淀积速率,电极反应就达到了平衡。电荷在电极/电解液界面附近发生了分离,就产生了所谓的电化学双电层(见下图左侧部分),它极其重要,是一切电化学反应的核心部分。

假如我们降低锂片电位的话,其实是让锂片上出现更多的电子而溶液里出现更多的锂离子(双电层被充电),于是固相电位降低,而液相电位提高。这时在等式右边,溶液里的锂离子能量升高,而电极上的电子能量也升高,所以平衡自然被破坏,会出现向左边的净反应。可见,电极电位影响氧化或者还原反应的速率以及平衡。
现在我们修正之前一个说法,就是认为把锂片放到 LiPF6 的 PC 稀溶液里时“应该”发生锂的净溶解。其实究竟发生净溶解还是净淀积,取决于锂片的电位。如果通过外加偏压使锂片的电位很负的话,如上所分析,溶液里的锂离子和电极上的电子的能量都可能太高,以至于反倒发生锂离子在电极上的沉积。
那么,到底 Li/Li+ 达到平衡的时候,对应的是什么电极电位呢?除非事先建立一套参考标准,否则这个问题我们现在还无法回答。因为电位,或者说电势,是一个相对的量。物理上某点处的电势取决于电势零点定义在哪里。电势差却不需要指定电势零点。如果我们将电极电位定义为电化学双电层两侧的电势差是否可以呢?且不论电解液里面的电势的定义本身的问题,由于双电层两侧的电势差无法直接测量(因为必然要插入另一个电极才能测量),这种定义对电化学而言显然不是一个好的定义。
在电化学上,我们真正谈论的不是某个金属自己的电位高低,而实际上是某金属电极跟它在电解液里面的离子的反应达到平衡时的电位,所以这种电位的零点,不能单单通过另一种物质,而只能通过某一种类似的氧化-还原反应对来定义。
电化学中,零电极电位人为定义成标准状况下氢气与水溶液中的 1M 活度的氢离子达到平衡时的电极电位,这种电极也称为标准氢电极。其余反应对的平衡电位,原则上可以通过其与标准氢电极组成电池的开路电压来测量。例如,假如 Li/Li+ 与 H2/H+ 组成假想电池的话,并暂不考虑锂与水的化学反应,那么由于 Li 比 H2 活泼,要维持两个反应都平衡的话,锂电极上势必要有更多的电子才能阻挡锂的净溶解,所以锂电极电位要比标准氢电极低,实验证明相对于标准氢电极,Li/Li+ 的平衡电位约为 -3.05 V。
用平衡电位不同的两个电极,就可以制造出开路电压出来。前面举的锂片与钴氧化物的例子,正好一个平衡电位极负,一个极正,两者做差就能得到很高的开路电压。
Li/Li+ 的平衡电位为什么比 Na/Na+ 负
钠(Na)是比锂更活泼的碱金属,但为什么 Li/Li+ 的平衡电位比 Na/Na+ 负呢?按照金属活动顺序表,似乎铯(Cs)应该是电位最负的负极材料才对?
要理解这个问题,仍然可以参考上面的图。所谓
![]()
的反应并不像公式写的这样简单。它至少包含三个过程。首先,一部分体心立方结构的金属锂要解体,让锂原子可以脱离晶格的束缚。其次,锂原子要发生电离,变成锂离子。这两步都是消耗能量的过程。最后,锂离子将极化周围的几个溶剂分子,发生溶剂化的过程,这个过程会放出能量。在一般的碳酸酯类有机溶剂中,锂离子一般与 4 个左右的溶剂分子牢牢结合成溶剂化的锂离子。
我们都知道锂跟水的反应不如铯跟水的反应那样剧烈。排除产物 LiOH 溶解度低,容易钝化锂表面的这个因素,这个现象也不难解释。主要是因为锂的电离能远比 Cs 的高。虽然锂的溶剂化可以释放出更多的能量,但反应的剧烈程度是一个动力学问题,而非热力学问题。由于反应的活化能高,所以金属锂在化学反应中总给人一种不如其他碱金属活泼的感觉。
然而,电极电位是一个热力学问题。何况,实际电极一般都在平衡电位附近工作。这时,锂的溶剂化能高的特点就体现出来了,因为热力学计算的是反应两侧总的自由能差。溶液中的锂离子若想淀积在锂电极上,首先就要克服这个溶剂化能。
锂的溶剂化能为什么那么高呢?主要是因为锂离子的半径很小,所以溶剂在距离锂核很近的地方被极化,自然感受到很强的极化电场。高的溶剂化能弥补了锂的高电离能,致使 Li/Li+ 的平衡电位反倒成为碱金属里面最负的。也可以理解为:锂离子被溶剂牢牢包围,以至于很难发生锂离子的沉积反应,所以在极负的电极电位下(固相电势很负而液相电势很正),锂的溶解/沉积反应才能达到平衡。
手机锂离子电池
下面我们讨论更实际一些的手机用锂离子电池。为了获得较高的电压,正极需要选用迫切渴求电子,氧化性高得恐怖的材料。+4 价钴的确够恐怖的了,无奈二氧化钴并不存在,即使存在也不会稳定。但这也难不倒我们,不妨先用含有 +3 价钴的钴酸锂 LiCoO2 制备正极,它可以被视为 CoO2 完全嵌锂被还原后的产物。这种材料是稳定存在的,具有一定的电子传导能力,而且是一种层状材料。其层间的锂离子可以脱嵌出去,而不会引起太大的形变,所以是较为理想的正极材料。我们可以拿锂片做负极,钴酸锂做正极,然后先充电,把钴酸锂中的锂离子赶到负极去,不就可以了吗?实际上发现,钴酸锂中的锂至多可以赶走一半。这是可以理解的,因为全赶走了则是不可能存在的二氧化钴。我们通过先制备“没电”的电池,再充电的方法,就得到了一部分 +4 价的钴。钴酸锂正极的反应依赖于 +4 价钴与 +3 价钴的氧化-还原对。+4 价的钴可是很恐怖的噢,这就是为什么钴酸锂正极的电池电压很高,但弄不好也容易爆炸的原因。
实际的手机锂离子电池负极用的并不是金属锂,而是石墨。石墨是良导体,可以做电极用,但本身的电位并不很负。然而,石墨是一种层状材料,碳六边形中心处,夹层之间可以嵌入锂,平均每六个碳原子可以嵌入一个锂。嵌入一定的锂之后,嵌锂石墨/Li+ 的电位就很接近 Li/Li+ 的电位了,只是略高零点几伏。
为什么不用金属锂做负极呢?这是出于充电安全性的考虑。充电时,锂离子并非均匀淀积在锂片表面上,而是有的地方锂比较厚,有的地方比较薄。锂越厚的区域,也就越接近正极,这样就越可能发生锂的优先淀积。长此以往,就容易形成锂枝晶。如果锂枝晶穿透了中间的隔膜,一直长到正极去,电池内部就短路了。而如果负极用石墨的话,锂离子在充电时要进入石墨内部的空隙处,而无法形成锂枝晶。因此,对于无需充电的一次性锂电池,负极往往就是金属锂。对于可充电的锂离子电池,负极一般用的是石墨,或者其他可以嵌锂的材料。由于没有了金属锂的存在,所以才叫“锂离子”电池。
在下一期中,我们将集中谈谈锂离子电池的正极材料。
参考文献:
廖淑芬,“剪不清、理還亂的元素活性關係”, http://chem.kshs.kh.edu.tw/teachshare/teach43-9608.pdf
https://wap.sciencenet.cn/blog-365047-866221.html
上一篇:AIP, APS 和 ECS 学术出版物最新动向浅析
下一篇:Siesta 能带结构计算中的 K 点坐标