博文
董俊超/陈纯团队揭示替代性末端结合途径介导B细胞抗体生成和染色体易位的机理
||
2021年9月30日,Cell Reports在线发表了由中山大学中山医学院与附属第七医院联合进行的关于体液免疫应答中抗体类别转换机制的研究。该研究表明结构特异的核酸内切酶XPF-ERCC1通过切割3’-单链DNA来促进B细胞内替代性末端结合介导的抗体类别转换,并促进致癌性染色体易位。
该项工作由中山大学中山医学院董俊超教授团队联合中山大学附属第七医院陈纯教授团队合作完成,并得到中国科学院大学/中国科学院上海分子细胞卓越创新中心孟飞龙研究员的支持和配合。
中山大学中山医学院博士生白婉瑜和朱广超为共同第一作者。

发生在外周免疫器官生发中心的体液免疫应答针对外来抗原产生浆细胞和记忆B细胞,生成不同类别的高特异性和高亲和力的抗体,体液免疫应答相关基因突变不仅可以引发抗体生成缺陷,导致持续慢性感染,而且与各型淋巴瘤的发生密切相关。在生发中心反应中,B细胞内的抗体类别转换(class switch recombination,CSR)将初始表达的IgM型抗体的重链恒定区替换为IgG、IgE、IgA等不同类别,对抗体的不同下游效应功能有至关重要的作用。从分子机制上看,CSR是一种DNA双链断裂(double-strand break,DSB)修复过程,由胞嘧啶脱氨酶AID在抗体重链基因(IgH)上IgM转换区(Sμ)和下游重组片段转换区(Sγ、Sα和Sα)内诱导产生DSB,由非同源末端接合(classical non-homologous end joining,c-NHEJ)将上下游转换区内的DSB进行连接。
同时,AID诱导的S区DSB能激活ATM依赖的DNA损伤应答(DNA damage response,DDR),激活下游效应分子如H2AX、53BP1等促进S区DSB以NHEJ方式进行修复。DDR因子的缺失导致CSR和抗体水平的显著降低。c-NHEJ的核心分子包括Ku70/80和XRCC4/Lig4复合物等,缺失其中任意一个分子将会导致NHEJ和CSR效率的显著降低,但对应的突变体细胞仍能以一定效率(野生型的~30-50%)进行替代性末端接合(alternative end joining,A-EJ)来生成抗体 (1)。目前对A-EJ的研究还比较有限,仅有报道PARP1、CtIP、DNA Lig3/Lig1等分子在此过程中的部分作用。
Dong et al. 前期研究结果表明, Lig4或53BP1缺失的B细胞中,S区的DNA双链断裂末端发生大量5’>3’的末端降解,促进微同源序列介导的末端接合(Microhomology-mediated end joining,MMEJ)发生率显著上升,且两中突变体MH特征谱高度相似 (2,3) 。由于S区DSB resection产生大量3’单链DNA(ssDNA), 这些ssDNA之间发生退火从而导致微同源序列的使用上升。然而这种退火结构往往形成较长的3’悬挂DNA,阻碍后续连接修复的完成,3’单链切除是细胞以一定效率进行A-EJ和抗体生成的必要条件。A-EJ CSR中的3’悬挂DNA是由哪种因子介导切除及其发生机制和影响,目前还没有系统的研究。
结合前期研究基础,本论文提出结构特异性5’->3’核酸内切酶复合物XPF-ERCC1可能参与切除抗体类别转换中的3’悬挂DNA。XPF-ERCC1参与哺乳动物细胞中多种DNA修复途径,包括核苷酸切除修复(NER)、链间交联(ICL)、同源重组(HR)和单链退火(SSA)等(4)。XPF-ERCC1-SLX4形成复合物结合并切割各种3’单链DNA,其中ERCC1介导底物结合,XPF行使核酸酶切割作用,SLX4作为支架将核酸酶复合物锚定在底物上,三者缺一不可。关于XPF和ERCC1对于抗体生成和CSR的作用的早期研究存在一定争议 (5,6)。
通过在小鼠成熟B细胞中分别敲除ERCC1/XPF/SLX4,Bai et al,发现它们不会影响野生型细胞的CSR效率,然而它们的缺失导致了代偿途径下的CSR效率降低了50%以上;通过验证不同的酶活性突变体,证实XPF-ERCC1的3’悬挂DNA切割功能对CSR起着至关重要的作用,而NER相关功能则不是必需的 (7)。高通量测序结果表明,代偿途径中更多地利用了降解DNA末端,而敲除ERCC1后使降解DNA末端的利用效率显著下降, 说明XPF-ERCC1-SLX4在替代性末端接合中起到切割3'悬挂DNA的作用。
随后作者检测了突变体中S区单链DNA含量,证实在c-NHEJ和DDR缺失的S/G2期细胞中DSB末端会发生降解,形成大量单链DNA。然而在ERCC1缺失细胞在代偿途径下,单链DNA含量却显著下降,这一现象部分依赖哺乳动物细胞中主要的3’核酸外切酶TREX1。作者认为发生这一现象的原因可能是处于代偿途径的细胞在持续的DDR信号激活下,倾向于删除那些无法被切割而影响基因组稳定性的单链DNA。
c-NHEJ或DDR途径因子缺失不仅会导致CSR水平的下降,而且可以在小鼠中形成各种B细胞恶性淋巴瘤,说明小鼠中c-NHEJ和DDR途径都会抑制淋巴瘤的产生(1)。这些淋巴瘤往往包含由AID介导的脱靶位点(如c-myc,BCL2等癌基因)内DSB与IgH恒定区内的DSB之间发生错位连接而产生的染色体易位,由IgH内的高活性增强子大大增强原癌基因的表达而驱动淋巴瘤的发生,这些特征与人类B细胞淋巴瘤 (如Burkitt’s lymphoma,DLBCL等)高度相似(1)。为验证XPF-ERCC1介导的A-EJ途径对致癌性IgH染色体易位的作用,作者以PCR法检测了各突变体中IgH到c-myc之间的染色体易位,发现在c-NHEJ缺失的小鼠B细胞中c-myc-IgH的易位频率显著上升,而敲除ERCC1后易位频率显著下降,进一步证实小鼠B细胞中A-EJ途径促进致癌性染色体易位的发生。
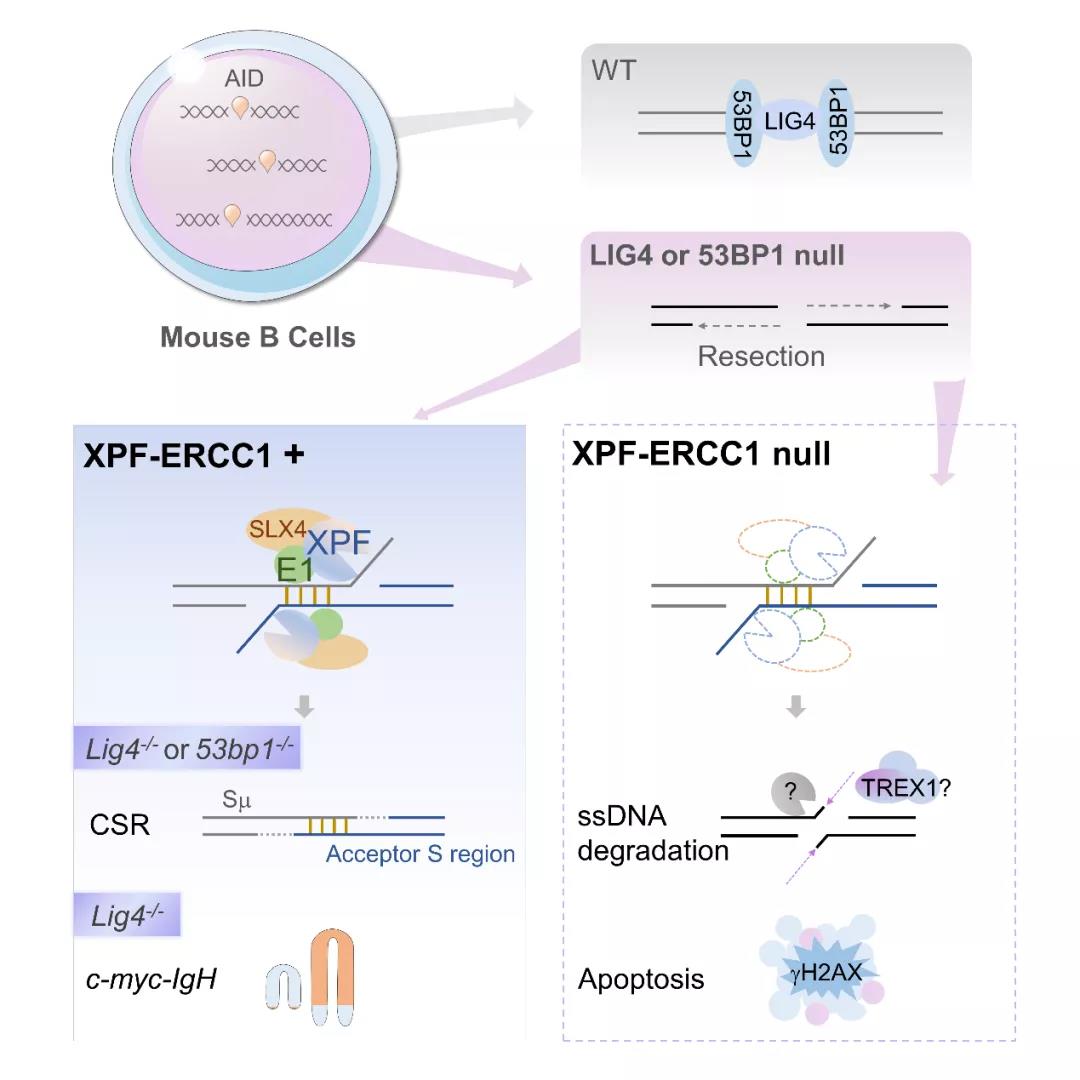
图1. B细胞中XPF-ERCC1参与A-EJ的作用机制。XPF-ERCC1通过切除3’悬挂DNA来参与代偿途径中的抗体类别转换, 并促进致癌性IgH-c-Myc染色体转位。在ERCC1与Lig4都缺失的B细胞中,S区3’单链DNA产生后因为不能被内切酶切除,而被核酸外切酶Trex1降解。
需要说明的是,本项目没有研究XPF-ERCC1对于生发中心内B细胞反应特别是B细胞发育类型和暗区高频突变、亲和力成熟等过程的影响。同时XPF-ERCC1缺失的A-EJ细胞仍可以更低但显著的效率生成抗体和切割3’单链DNA,显示仍有其他核酸酶可以替代XPF-ERCC1参与到3’单链DNA切割和A-EJ修复中来。作者推测,XPF的类似物Mus81可能是一个这样的分子(4)。另外,最近发现的3’单链DNA内切酶Aste1可以降解53BP1突变细胞中产生的ssDNA, 也可能是一个潜在的替代因子(8),但作者排除了另一个报道有类似作用的3’单链核酸酶Artemis参与A-EJ介导的CSR的可能性(7)。
此外有研究显示,人类细胞中的染色体易位由c-NHEJ而非A-EJ所驱动,这些研究多使用定点诱导的核酸内切酶(如I-SceI,Cas9, TALEN和ZFN等)来进行,其在生理和病理过程特别是淋巴瘤发生中作用还没有仔细研究(9)。是否XPF/ERCC1在人类细胞中有类似促进A-EJ介导的致癌性染色体易位的功能,乃至更进一步,是否XPF/ERCC1可以作为抑制这种染色体易位的药物开发靶点,还有待进一步探索。
总之,本研究表明3’单链核酸内切酶XPF/ERCC1促进以A-EJ途径参与抗体类别转换和IgH-c-myc染色体易位,对完善体液免疫应答中的抗体生成机制,系统揭示A-EJ过程及致癌性染色体易位的发生机制提供了新的思路。
相关论文信息:
https://doi.org/10.1016/j.celrep.2021.109756
参考文献
1. Alt FW, Zhang Y, Meng FL, Guo C and Schwer B. Cell (2013) 152, 417-429. 2. Dong, J., Panchakshari, R.A., Zhang T et al.. Nature (2015) 525, 134-139. 3. Panchakshari, et al., Dong J and Alt FW. PNAS (2018) v115:762-767 4. Dehé PM, Gaillard PHL. Nat Rev Mol Cell Biol. (2017); v18(5):315-330. 5. Tian M et al.,. Mol.Cell Biol. (2004) v24, 1200-1205 6. Schrader CE et al., J. Exp Med (2004) v200: 321-330 7. Bai W et al., Cell Reports (2021), in press 8. Zhao F et al., Nat Cell Biol. (2021) 23(8):894-904 9. Ghezraoui H et al. Mol Cell. (2014) 55(6):829-842
https://wap.sciencenet.cn/blog-3423233-1306330.html
上一篇:程晓东/施蕴渝/Merlin Crossley合作阐明ZBTB7A特异识别γ-珠蛋白启动子序列的分子机制
下一篇:NBT突破!闵玮团队开发多重三维组织成像技术助力解析复杂生物组织