博文
《自然—方法》:中山大学骆观正团队提出系统校正表观转录组图谱的新方法
||
RNA上已发现存在超过150种化学修饰,这些修饰或参与了RNA与其它大分子的相互作用,或影响了RNA本身的代谢,在基因表达调控中起着至关重要的作用,从而促进了“表观转录组学”这一新兴领域的诞生和发展【1,2】。
准确且定量地鉴定RNA修饰位点及其修饰比例,有助于我们深入了解RNA修饰的分布、功能及其背后的机理机制【3,4】。然而如何获得高置信度、单碱基精度的RNA修饰位点,以及对修饰位点的精准定量,目前仍然是领域内的研究难点。
北京时间2021年9月30日晚23时,中山大学骆观正团队在Nature Methods杂志上发表研究论文——“Systematic calibration of the epitranscriptomic maps using a synthetic modification-free RNA library“。 该研究使用构建全转录组无修饰RNA文库作为负对照的策略,全面评估了现有的基于二代测序的RNA修饰检测方法,并为修饰位点的精确鉴定提供系统性的解决方案。

近年来,新技术的蓬勃发展为RNA修饰位点的鉴定提供了多种方案。主要的检测方法可分为片段富集(fragment enrichment)、序列截断(sequence truncation)和碱基转换(nucleotide transition)三大类【5,6】。尽管已有多种方法可供选择,但是在实际研究中,对同一种修饰的不同研究结果之间经常会存在差异。某些情况下,不同的研究所鉴定到的修饰数量甚至能相差2-3个数量级【7】。即使对于目前相对成熟、应用最广的MeRIP-seq技术,也存在大量非特异性抗体富集和低重复性问题【8,9】。
面对噪音较大的生物数据,研究者经常会引入对照来鉴别假阳性。在前人的研究中,为了提高现有修饰检测方法的可信度,有时会利用负对照样本对结果进行校正。主要采用的方法是使用体内或体外反应去除了修饰位点的样本作为对照,亦或是使用合成的无修饰的RNA oligo来评估方法的效率和准确性。然而这些负对照样本也会存在较大不足,比如体外反应很难完全去除修饰位点,合成的RNA oligo只能代表部分序列等。因此,最好的负对照样本应该具有与内源转录组同样的序列和基因表达水平,但是并不含有修饰碱基的一套完整的人工转录组。本研究采用体外合成全转录组RNA (IVT RNA) 文库的方法构建了一套无修饰的RNA文库。通过RNA-seq和质谱检验,验证了该文库与内源转录组有一致的表达量,但不含有修饰碱基(图1)。随后研究者将其作为负对照加入到现有的修饰检测方法中,用来发现和去除假阳性信号。文中以两种最受关注的RNA修饰m6A和m5C作为代表,分别设计了片段富集(MeRIP-seq)、序列截断(m6A-REF-seq)和碱基转换(BS-seq)三种不同的应用场景(图1)。
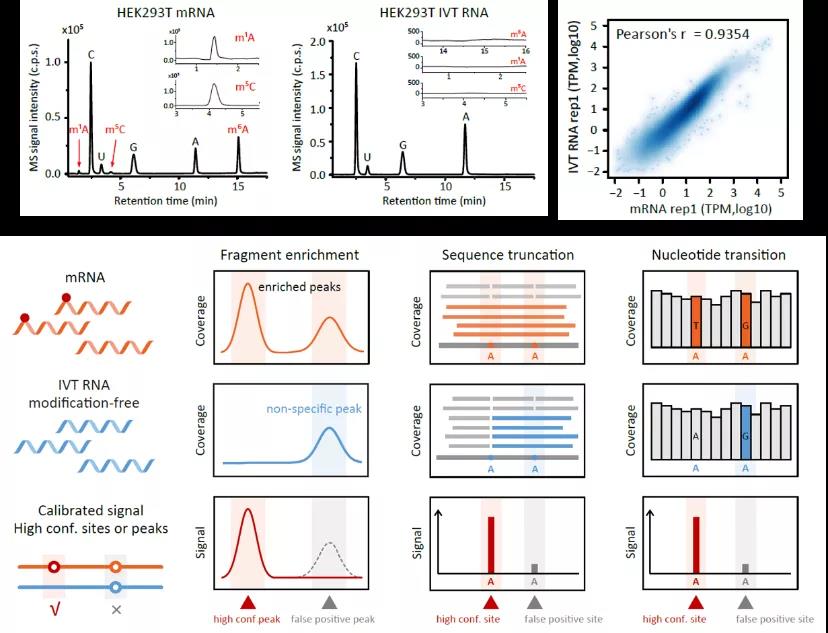
图1 体外合成RNA文库(IVT RNA)具有与内源转录组相似的表达量,但不含有修饰碱基。使用IVT RNA校准RNA修饰检测的三个应用场景
MeRIP-seq(或m6A-seq)是目前最常用的RNA修饰检测方法,被大范围的用在m6A相关研究中。该方法原理是用m6A特异性的抗体对片段化的RNA进行免疫沉淀反应,将含有m6A的片段富集出来进行测序。在本文中,研究者同时对体外转录IVT RNA文库也进行MeRIP-seq,结果发现即使是对不含m6A修饰的IVT RNA文库,抗体依旧能够富集到大量RNA片段,并且这些富集的“peak”在已发表结果数据中重复出现(图2),表明MeRIP-seq其实受到假阳性信号的干扰。分析IVT RNA中被富集的“peak”区域,发现这些区域所在的基因表达量较高且富含腺嘌呤。去除假阳性信号后,鉴定出来的修饰区域更准确。
对于使用序列截断鉴定修饰位点的检测策略,研究者将IVT RNA文库应用在m6A-REF-seq测序方法上。m6A-REF-seq利用对m6A敏感的内切核酸酶MazF来鉴定m6A修饰位点,可达到单碱基精度。该方法由骆观正课题组和以色列魏茨曼科学研究学院Schraga Schwartz组在2019年分别独立发表,两个课题组分别使用了体外去甲基化反应和体内敲除甲基转移酶的方式来降低该方法的假阳性【10, 11】。在本研究中,作者将IVT RNA样本作为负对照进行m6A-REF-seq检测,发现确实存在大量未被切开的位点,使用IVT RNA样本对m6A位点进行校正,得到了更精确的修饰位点信息。高精准度的m6A单碱基图谱也为该领域提供了新的知识,如扩展motif序列,定量分布规律等,为进一步深入分析m6A的机制和功能创造了前提(图2)。
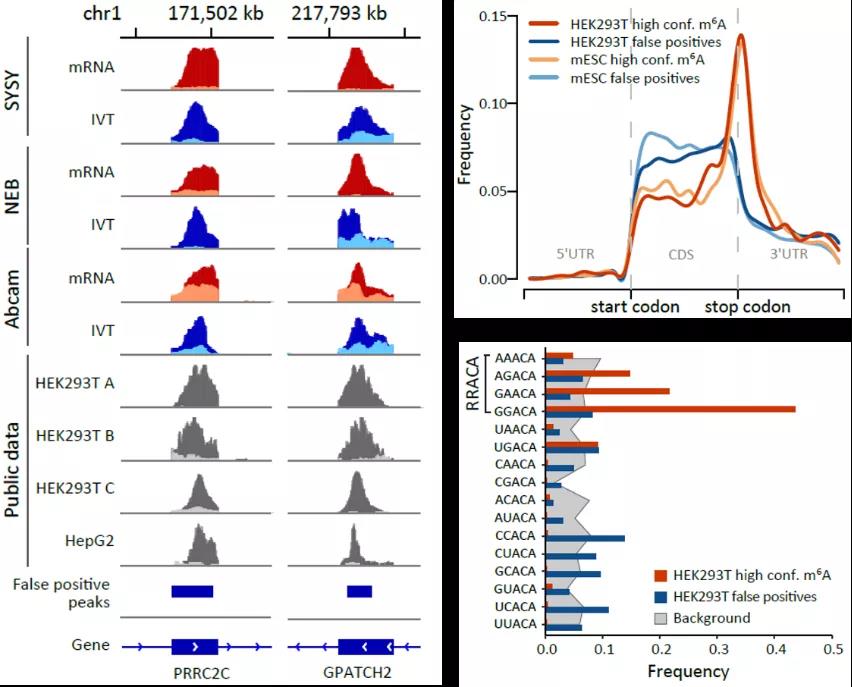
图2 使用IVT RNA文库对MeRIP-seq和m6A-REF-seq进行校正
最后研究者把IVT RNA应用到第三种碱基转换策略的RNA修饰检测中。BS-seq使用重亚硫酸盐对不含修饰的C进行处理,使其在PCR之后转换为T,而m5C修饰并不能进行该转换。在实验中如果处理不完全,会为m5C修饰鉴定引入大量的假阳性位点。研究者在BS-seq中加入IVT RNA作为负对照鉴定m5C位点,得出高置信度的m5C位点。同时发现即使重亚硫酸盐处理得不是非常严格,引入IVT RNA依然能够起到明显的校正效果,降低检测结果中的假阳性。
综上,该研究提供了一种体外合成全转录组无修饰RNA(IVT RNA)的方法,并将该方法应用于三类主要的RNA修饰检测策略中,系统性地对常用的RNA修饰检测方法进行评估和校正,提高了修饰位点检测的准确性,获得了高置信度位点信息和定量图谱。相对于使用体内敲除甲基转移酶样本作为负对照,IVT RNA可以保证完全无修饰,且合成方便快捷,不受物种和样本本身的限制,有望成为目前和未来RNA修饰检测的金标准。
中山大学生命科学学院副研究员张璋和博士后陈涛为共同第一作者,骆观正教授为通讯作者。中国科学院广州生物医药与健康研究院陈捷凯研究员、北京大学贾桂芳研究员和中山大学杨建华教授为该研究提供了帮助。文中所涉及到的方法已申请发明专利。
相关论文信息:
https://doi.org/10.1038/s41592-021-01280-7
参考文献
1. He, C. Grand Challenge Commentary: RNA epigenetics? Nat. Chem. Biol. 6, 863–865 (2010). 2. Saletore, Y. et al. The birth of the Epitranscriptome: deciphering the function of RNA modifications. Genome Biol. 13, 8–12 (2012). 3. Roundtree, I. A., Evans, M. E., Pan, T. & He, C. Dynamic RNA Modifications in Gene Expression Regulation. Cell 169, 1187–1200 (2017). 4. Zaccara, S., Ries, R. J. & Jaffrey, S. R. Reading, writing and erasing mRNA methylation. Nature Reviews Molecular Cell Biology 20, 608–624 (2019). 5. Linder, B. & Jaffrey, S. R. Discovering and mapping the modified nucleotides that comprise the epitranscriptome of mRNA. Cold Spring Harb. Perspect. Biol. 11, 1–16 (2019). 6. Helm, M. & Motorin, Y. Detecting RNA modifications in the epitranscriptome: Predict and validate. Nat. Rev. Genet. 18, 275–291 (2017). 7. Grozhik, A. V. & Jaffrey, S. R. Distinguishing RNA modifications from noise in epitranscriptome maps. Nat. Chem. Biol. 14, 215–225 (2018). 8. Helm, M., Lyko, F. & Motorin, Y. Limited antibody specificity compromises epitranscriptomic analyses. Nature Communications 10, 5669 (2019). 9. McIntyre, A. B. R. et al. Limits in the detection of m6A changes using MeRIP/m6A-seq. Sci. Rep. 10, 1–15 (2020). 10. Garcia-Campos, M. A. et al. Deciphering the “m6A Code” via Antibody-Independent Quantitative Profiling. Cell 178, 731-747.e16 (2019). 11. Zhang, Z. et al. Single-base mapping of m6A by an antibody-independent method. Sci. Adv. 5, eaax0250 (2019).
https://wap.sciencenet.cn/blog-3423233-1306327.html
上一篇:何平/单立波研究组首次在植物中鉴定到一种新型蛋白翻译后修饰
下一篇:《自然—方法》:姜鹏/Kai Wucherpfennig开发CytoSig大数据平台辅助细胞因子免疫信号通路研究