博文
李文博团队揭示eRNA化学修饰在增强子激活基因转录过程中的作用
||
增强子 (enhancer) 发现迄今刚好40年【1,2】。从最初一类让人好奇的提高基因表达的调节元件到逐渐被认识到的在发育和细胞命运决定过程中的重要作用,再到在(表观)基因组水平的大量存在,以及和几乎所有人类疾病的紧密联系,增强子是迄今最重要的基因表达调控序列之一【3,4】。了解增强子的作用机制不仅有助于了解基因表达在复杂的人体发育过程中如何实现,也有助于发展新的针对它们的疾病治疗方式。
过去十年人们认识到增强子不仅是DNA调控元件,也广泛转录成RNA。这类RNA被称为增强子RNA(enhancer RNA)或者eRNA【5,6,7】。eRNA据估计在人类细胞和组织内有超过六万个【8】。在增强子激活基因表达的作用过程,eRNA的功能已有报道,但是作用机制仍然未明【7】。
北京时间2021年8月9日晚23时,美国德克萨斯大学休斯敦健康科学中心麦格文医学院的李文博团队在Molecular Cell杂志上发表了一篇题为“Enhancer RNA m6A methylation facilitates transcriptional condensate formation and gene activation” 的文章。 这项研究揭示了eRNA的化学修饰在增强子的激活基因转录过程中的作用,提供了新的增强子和增强子RNA在人类基因表达调控中的机制。

李文博课题组过去几年专注于阐述增强子RNA的作用机制和在疾病中的作用。在这篇论文中,研究的最初的问题是RNA的化学修饰是否在增强子RNA或者增强子激活基因转录过程中起作用。过去多年以芝加哥大学何川为首和其他同仁的发现说明N6-methyladenosine (m6A)在mRNA上丰度最大【9】,于是课题组最先专注在m6A上。为了克服eRNA总体上的短生命周期等困难,作者们使用了4SU标记新生RNA (nascent RNA),然后再结合抗体共沉淀的方式把在新生RNA水平的拥有m6A修饰的部分富集测序(图一)。

图1。MINT-seq的简要实验流程。
这个新技术methylation inscribed nascent transcript sequencing (MINT-Seq)显示大量的新生RNA具有m6A化学修饰,能够看到的具备修饰的eRNA十倍于常规的total RNA-seq 及MeRIP-seq。除了eRNA之外,课题组也观察到promoter upstream antisense RNA(uaRNA)也具备很普遍m6A修饰。虽然如此,m6A在eRNA上的存在具备选择性。较长的较稳定的eRNA具备比较高的m6A修饰。有些eRNA甚至能转录超过20kb【图二】。

图2。示意图。基于本论文的观察,较长的,较稳定的eRNA具备较高的m6A修饰。eTSS: enhancer transcriptional start site。
通过生物素标记的RNA 沉淀和质谱分析,课题组发现细胞核内m6A读取蛋白YTHDC1是结合m6A修饰的eRNA的首要蛋白。于是接下来,作者们做了ChIP-Seq,发现在MCF7乳腺癌细胞中YTHDC1主要结合在增强子区域,并和m6A修饰的eRNA有很好的共定位【图三】。

图 3。在MCF7细胞中的YTHDC1主要和增强子其他调控因子共定位,譬如BRD4。
功能学的研究表明,YTHDC1的敲低,不管是使用siRNA,shRNA还是HaloTag介导的快速降解,都会负面影响增强子的受控激活。类似的,敲低已知的m6A的甲基化酶METTL3和METTL14也会造成类似的作用,只是课题组也看到长期的敲低这两个重要酶复合物也许会导致间接的对转录的改变。此外,课题组还通过其他方法验证了m6A在eRNA功能上的直接作用,包括使用酶失活的RfxCas13d来带入FTO介导的m6A擦除,也包括使用最近的针对YTHDC1和METTL3的化学抑制剂。
最近的在转录领域的研究表明很多转录的重要调控因子能够有相分离的性质,而有助于形成转录凝聚体(transcriptional condensates)【10,11】。但凝聚体的功能调节还知之甚少。RNA结合蛋白是已知的具备相分离能力的重要蛋白质,且其能力被RNA结合影响【12,13】。那么eRNA结合蛋白在转录过程的作用是否有可能通过相分离来实现呢。课题组发现YTHDC1不论在体内或者体外都有相分离的性质,这个和细胞质的m6A读取器YTHDF蛋白类似(只是他们的起作用的氨基酸构成很不同)。在体外,m6A修饰的eRNA会增强YTHDC1相分离的尺寸,和细胞内的观察一致。
有趣的是,YTHDC1和eRNA形成的复合物会促进BRD4的复合物形成更大尺寸的聚合体。BRD4是已知的重要转录激活蛋白,并和YTHDC1在ChIP-seq水平上有很好的共定位【图三】。YTHDC1的敲低不论在显微镜观察还是ChIP-Seq水平上都会负面影响BRD4的凝聚体以及和增强子的结合。这些结果提示m6A修饰的eRNA是通过招募YTHDC1,在增强子附近形成凝聚体,从而正向调节增强子和转录激活【图四】。
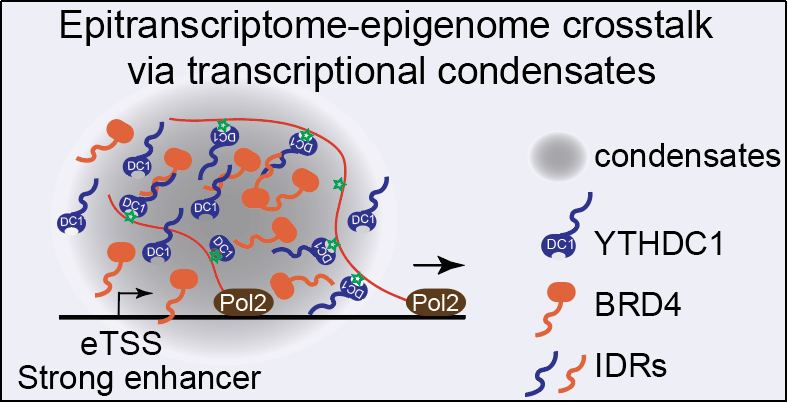
图4. 模型图:eRNA的m6A标记招募核内阅读蛋白,调节转录凝聚体和转录激活。
此论文揭示了eRNA在增强子和转录激活中的新的作用机制,即eRNA的分子本身通过化学修饰招募读取蛋白从而调节转录凝聚体的形成和活力。这个发现有几个重要的意义。第一,它说明eRNA的转录本分子和转录过程在增强子的活化过程中都有重要作用,解决了这个方面多年来的一些争议。第二,本文说明m6A在转录中有直接作用,区别于此前绝大多数发现这个化学修饰在RNA转录后水平的作用。第三,此文发现的YTHDC1相分离和BRD4的凝聚体之间的相互作用提供了一个新的RNA结合蛋白在转录过程中发挥作用的基本机制,揭示也许这种“凝聚体合作”是一个广泛的转录调节机制。
此外,作者们观察到的一些有趣的现象也值得进一步探索。比如长eRNA和短eRNA之间的转录和功能差别如何产生,以及m6A修饰在新生RNA共转录过程的添加的基本过程如何。YTHDC1的相分离依赖于其蛋白C端的一个无序构域和其中的arginine氨基酸。具体什么样的氨基酸之间的化学特性让YTHDC1形成凝聚体并和BRD4相互作用还不清楚。因为enhancer功能失调在疾病中的重要作用,此文也提供了调节enhancer在疾病中作用的新靶点和思路。
博士后李宙炯(韩国籍),博士生王若愚,博士后熊峰是论文共同第一作者。此工作也得到麦格文医学院的蔡光磊组,圣安东尼奥德克萨斯健康中心刘志杰组,贝勒医学院Josephine Ferreon,Michael Mancini组,以及苏黎世大学Amedeo Caflisch组的参与。初期投稿阶段论文得到芝加哥大学何川老师建议。德克萨斯Texas A&M大学黄韵老师提供了一些细胞及其他帮助。
李文博老师组目前有两个博后职位空缺,欢迎有志致力于RNA和表观遗传研究的同学加盟。
相关论文信息:
https://doi.org/10.1016/j.molcel.2021.07.024
参考文献
【1】Banerji, J., et al. (1981). Expression of a beta-globin gene is enhanced by remote SV40 DNA sequences. Cell 27, 299-308. 【2】Moreau, P., et al. (1981). The SV40 72 base repair repeat has a striking effect on gene expression both in SV40 and other chimeric recombinants. Nucleic acids research 9, 6047-6068. 【3】Furlong, E.E.M., and Levine, M. (2018). Developmental enhancers and chromosome topology. Science 361, 1341-1345. 【4】Maurano, M.T., et al. (2012). Systematic localization of common disease-associated variation in regulatory DNA. Science. 337(6099):1190-5. 【5】Kim, T.K., et al. (2010). Widespread transcription at neuronal activity-regulated enhancers. Nature 465, 182-187. 【6】De Santa, F., et al. (2010). A large fraction of extragenic RNA pol II transcription sites overlap enhancers. PLoS biology 8, e1000384. 【7】Li, W., Notani, D., and Rosenfeld, M.G. (2016). Enhancers as non-coding RNA transcription units: recent insights and future perspectives. Nature reviews Genetics 17, 207-223. 【8】Arner, E., et al. (2015). Transcribed enhancers lead waves of coordinated transcription in transitioning mammalian cells. Science 347, 1010-1014. 【9】Nachtergaele, S., and He, C. (2018). Chemical Modifications in the Life of an mRNA Transcript. Annual review of genetics 52, 349-372. 【10】Hnisz, D., et al. (2017). A Phase Separation Model for Transcriptional Control. Cell 169, 13-23. 【11】Lyon, A.S., et al. (2021). A framework for understanding the functions of biomolecular condensates across scales. Nature Reviews Molecular Cell Biology. 22(3):215-235. 【12】Lin, Y., et al. (2015). Formation and Maturation of Phase-Separated Liquid Droplets by RNA-Binding Proteins. Molecular cell 60, 208-219. 【13】Roden, C., and Gladfelter, A.S. (2021). RNA contributions to the form and function of biomolecular condensates. Nature Reviews Molecular Cell Biology. 22(3):183-195.
https://wap.sciencenet.cn/blog-3423233-1299087.html
上一篇:谭敏佳/黄敏团队合作揭示KRAS突变肿瘤的分子分型和精准治疗新策略
下一篇:北大深研院周强实验室报道小清蛋白神经元精准调控记忆形成与表达的机制