博文
中芬科学家合作构建人工信号和生物信号交互的载药平台提高肿瘤靶向
||
北京时间2021年5月25日晚23时,芬兰赫尔辛基大学Hélder A. Santos教授、上海交大瑞金医院崔文国教授和芬兰埃博学术大学张宏博教授团队合作在Cell Reports发表封面文章——“Multistage signal-interactive nanoparticles improvetumor targeting through effificient nanoparticle-cellcommunications”,构建了人工信号和生物信号交互的载药平台来提高肿瘤靶向。
Hélder A. Santos教授、崔文国教授和张宏博教授为论文共同通讯作者,张峰、张一然和孔丽为共同第一作者。


纳米材料设计的初衷是用来干预或者调控细胞行为以此实现治疗的目的,这在大量的体外实验中已经得到了证实。然而,当在体内应用时,情况却截然相反,纳米材料的命运更多的是取决于外部生物环境的选择。这在肿瘤治疗中表现为低效的肿瘤靶向效率(或肿瘤特异性积累效率)。尽管已经有海量的工作来对纳米给药体系进行优化,但临床或者动物实验的效果却往往远低于人们对于纳米药剂的预期。
纳米药剂区别于(或者优于)传统药剂的关键是,传统药剂直接通过药物分子对生物大分子进行分子层面的信号干预,因此缺乏细胞层级的选择性,而纳米药剂则可以进行细胞层级的交流,表现出对不同细胞的选择,以此最终实现靶向治疗。然而,在传统的以“载药体系”为框架的纳米颗粒的设计中,“信号载体”的属性被严重低估。这导致了在生物体内这个巨大的生物信号交互体系中,纳米颗粒缺乏与外界有效的信号交互手段而造成的低效的颗粒-细胞的交流效率及纳米颗粒稳态的丧失,最终表现为严重的免疫清除,低效的肿瘤靶向能力及治疗效力。
有效的信号集成及信号处理能力是强化纳米药剂的颗粒-细胞交流效率的关键。芬兰赫尔辛基大学Hélder A. Santos、上海交大瑞金医院崔文国教授和芬兰埃博学术大学张宏博教授团队通过将两种信号多肽(自我肽“Self peptide”和靶向肽“YIGSR peptide”)通过化学修饰整合为一条可以化学拆分的嵌合体多肽,在硅基纳米颗粒上构建了一个多层级信号表面,以此实现纳米颗粒对于人工信号和生物信号的多级信号交互来增强颗粒的稳态及可操控性。
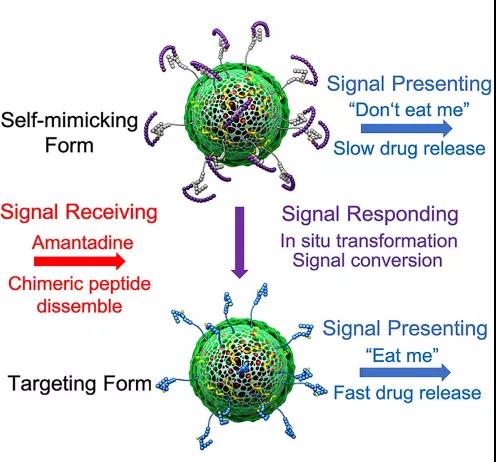
图文摘要
其中,通过固相合成端基功能化的β-环糊精(β-CD)-自我肽可以屏蔽靶向肽的“增强摄入”的信号,并进一步通过与细胞表面的SIRPα蛋白相互作用来规避细胞摄入,在这种“屏蔽靶向”及“自身伪装”的双重作用下,免疫细胞和正常细胞对于颗粒的摄入大大降低,这也表现为以肝脏为代表的单核吞噬系统(MPS)对颗粒的积累降低,及排出加快。当颗粒通过被动靶向等作用在肿瘤组织富集后,通过后续注射入金刚烷胺,自我肽从颗粒表面被竞争解离,此时伪装态的颗粒原位转化为靶向态,以此增强在肿瘤组织中的细胞摄入能力,从而进一步提高肿瘤治疗效力。
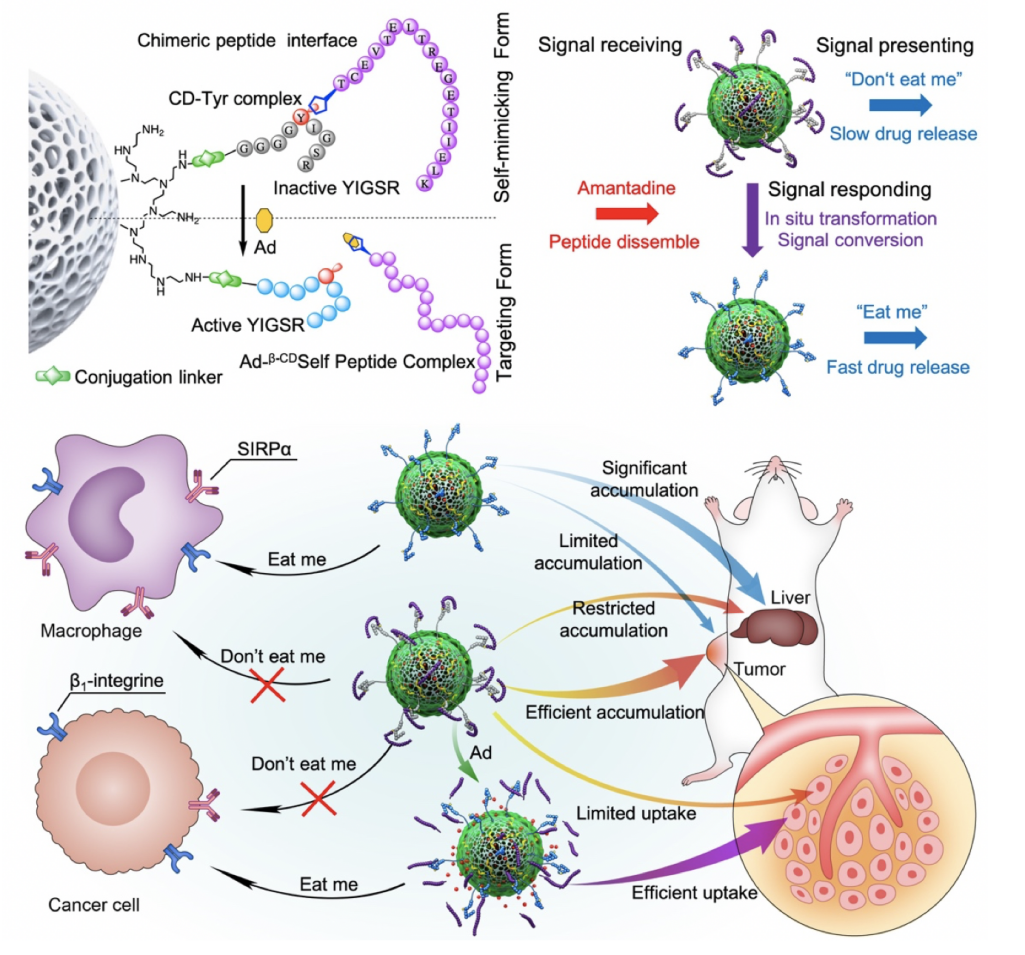
在颗粒的体内分布实验中,作为对照的非信号交互体系(单一靶向体系)的肿瘤-肝脏平均荧光强度积累比(Ratiotumor/liver),在6,48和72小时的数值分别为:0.45, 0.40和0.37,说明此中颗粒被肝脏大量截流并长期滞留在肝脏中,而肿瘤部位的积累非常有限。而信号交互体系的Ratiotumor/liver数值则为:0.92, 1.45和2.06,显示了显著增强的肿瘤部位的积累。在相同时间点上,实验组的肿瘤部位荧光强度分别为对照组的1.3, 2.3 和 2.8倍,而肝脏部位的荧光强度则为65%, 62% 和51%。
在后续的抑瘤实验中,经过金刚烷胺激活的信号交互颗粒组的治疗效果也显著优于其他各对照组,瘤体平均重量仅为单一靶向体系的15.4%。此外,在安全性评估中,单一靶向体系于信号交互体系均未展现出显著的肝、肾及血常规的急性毒性。但是在小鼠经历了35天的载药颗粒的治疗后,单一靶向体系的H&E切片显示了明显的肝脏细胞病变损伤,而信号交互体系组的肝损伤则不明显。
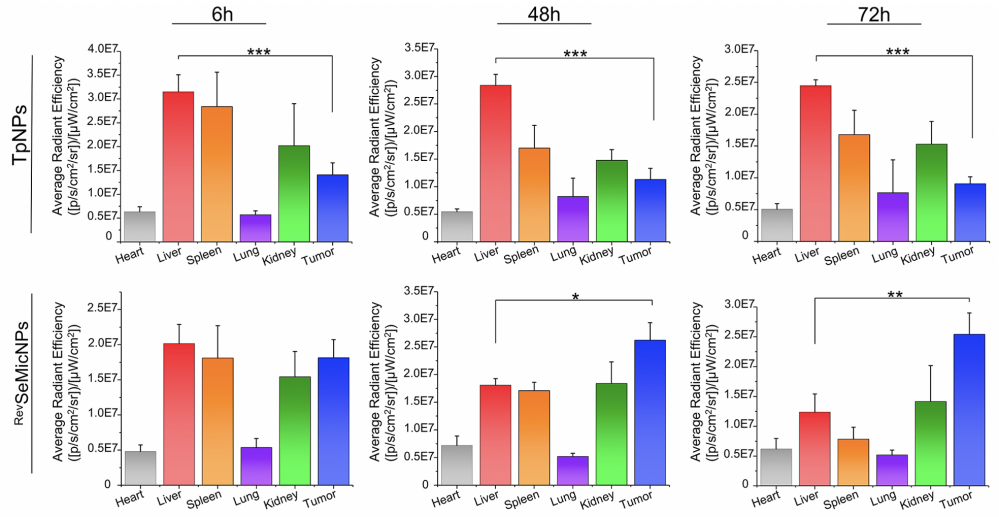
这项研究从颗粒-细胞交流效率决定的颗粒稳态的视角来审视了纳米颗粒的靶向问题,并通过构建仿细胞动态信号交互的多级信号交互系统来增强纳米里的可操控性,以此提高了颗粒的肿瘤特异性积累效率及体内应用的安全性。此外,该项研究也强调了纳米颗粒作为信号载体的重要属性,提供了一种通过纳米颗粒进行多元生物信号整合与调控的策略,为后续的纳米药剂的临床过渡提供了新的思路。
崔文国,教授/博导,上海交通大学医学院附属瑞金医院/上海市伤骨科研究所。主要基于转化生物医用材料,从事骨、关节等组织修复重建的研究。以第一/通讯作者发表SCI论文140余篇(IF>10的40余篇),引用8000多次,H=48,专利50多项(转化2项),主编Elsevier书籍1本、参编9本国际书籍章节。多本杂志的编委和客座主编。任中国生物材料学会理事、康复医疗生物材料副主任委员等。(欢迎致力于再生医学材料研究、临床和产业化的各专业博士后加盟该团队,50555736@qq.com)
相关论文信息:
https://doi.org/10.1016/j.celrep.2021.109160
https://wap.sciencenet.cn/blog-3423233-1288300.html
上一篇:孙倍成与林安宁研究团队合作揭示肝癌炎癌转化调控新机制
下一篇:何聪聪小组首次报道自噬蛋白非细胞自主性地调节代谢的新机制