博文
综述:细胞膜仿生—纳米生物医药新技术
||
Cell Membrane Coating Technology: A Promising Strategy for Biomedical Applications
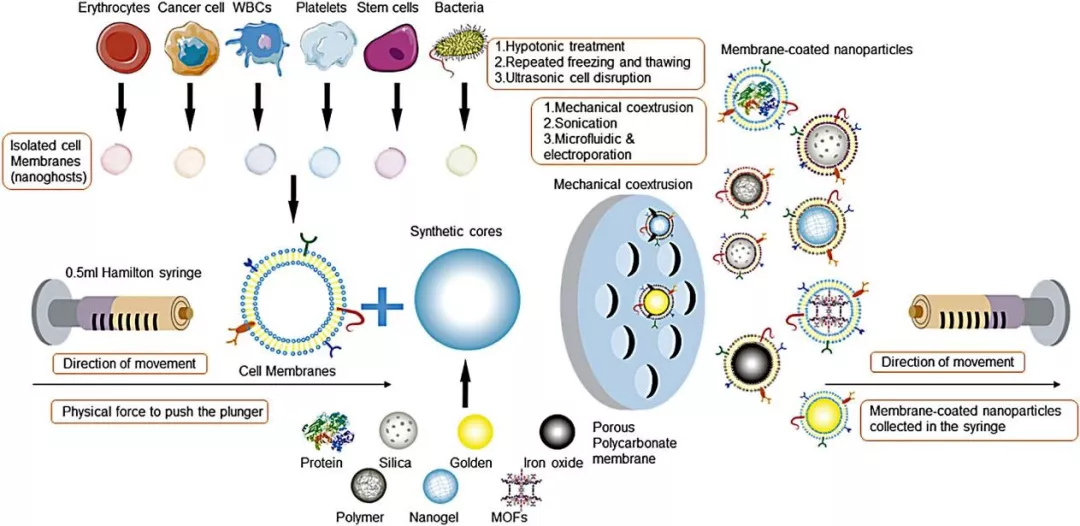
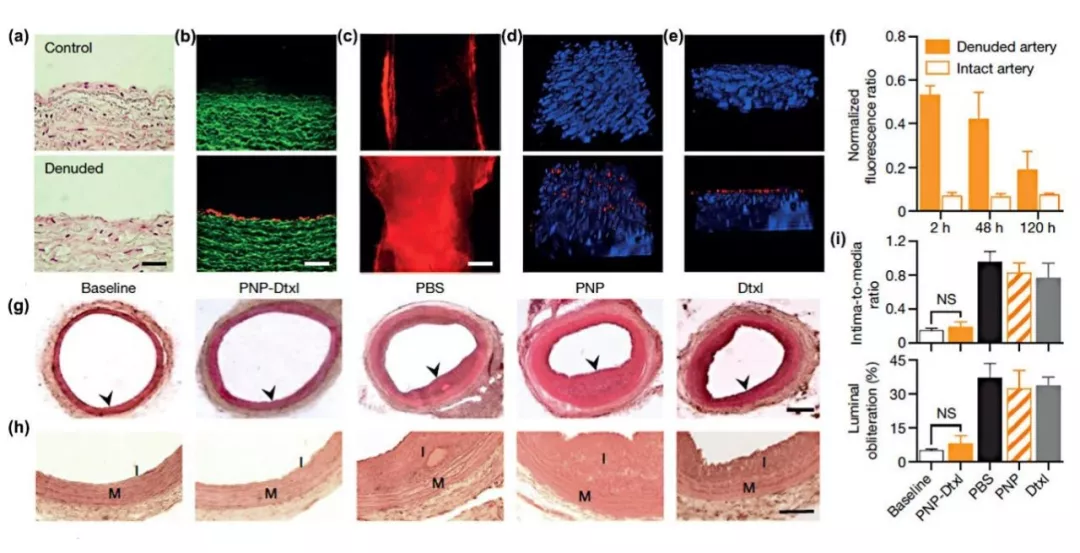
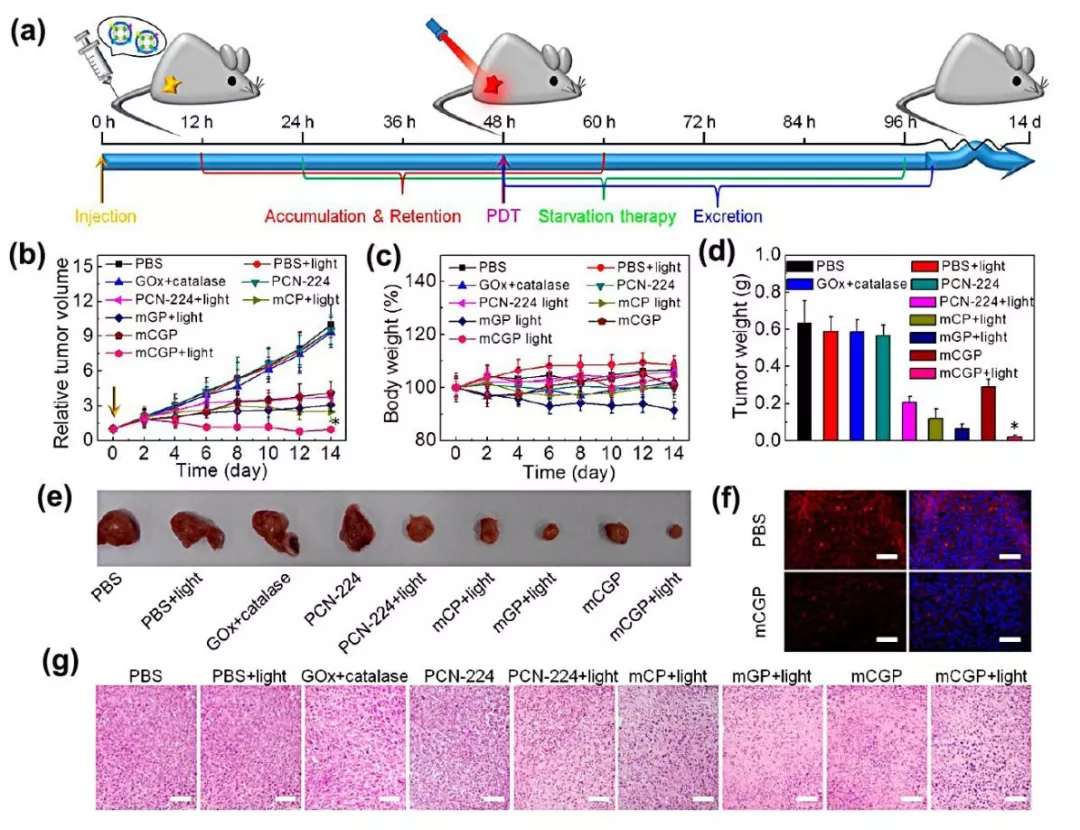
Nano-Micro Lett.(2019)11:100 https://doi.org/10.1007/s40820-019-0330-9 本文亮点 细胞膜仿生技术是一种仿生复制细胞膜特性的方法,将天然细胞膜特性与人工内芯材料的特性结合起来,从而大大提高生物相容性,同时在体内实现长效循环和靶向递送。尽管细胞膜包裹的纳米粒具有明显的优势,但在其应用于临床之前还有很多工作要探索。 在这篇综述中,作者首先对细胞膜仿生技术的理论进行了全面概述,总结了现有的制备和表征技术。接下来,重点介绍了各种细胞膜类型的功能和应用。此外,作者整理了用于细胞膜仿生技术的模型药物,并回顾了过去十年来与该技术相关的专利申请。最后,作者对这项技术的未来挑战和趋势进行了展望,以期对细胞膜仿生技术的未来发展提供一个全面的概述。 研究背景 细胞膜包裹的纳米粒融合了原细胞和内核纳米粒的优点。这种细胞膜仿生技术的起源可以追溯到2011年,张良方课题组首次报道了这项技术,他的团队采取自上而下的策略,利用完整的细胞膜包裹纳米粒。与合成的“隐形”颗粒相比,被红细胞膜包裹的纳米颗粒在小鼠体内的半衰期更长,在循环中的滞留时间长达72小时。所制备的纳米颗粒既具有纳米载体本身的理化性质,又具有天然细胞的生物学性质。细胞膜实现免疫逃避不是通过躲避来完成的,而是穿上敌人的军装,膜蛋白相当于它们的通行证,使得它们能在体内大方自由地运送。常规的细胞膜包裹纳米粒的制备可分为三个关键步骤:膜提取、内核纳米载体的制备和融合(图1),每一个步骤都是纳米粒功能化的关键。 光治疗是主动肿瘤治疗研究的一个主要领域,红细胞膜长循环特性在这一背景下具有很大的价值。血小板的粘附特性为克服光敏剂和光热转换材料在光治疗中分布不均的局限性提供了解决方法。光热治疗依赖于热损伤诱导癌细胞死亡,而这种损伤后的反馈可以促进血小板的被动靶向性,导致其额外的募集和光热效应的增强。白细胞包裹的纳米粒被证明是非常适合光治疗的理想粒子,可提高体内活性光敏剂/光热化合物的生物相容性和靶向性。已经开发出的几种用于光治疗的癌细胞膜包裹纳米粒子能够有效地靶向同源肿瘤,以传递光敏剂/光热化合物,并且与化疗或肿瘤饥饿策略相结合,能够达到显著的抗肿瘤效果(图4)。 中性粒细胞作为外周血中最丰富的白细胞,对炎症信号有天然趋化的作用,在化疗或放疗中起着关键作用。癌细胞膜提供了一系列肿瘤相关抗原,以刺激肿瘤特异性免疫应答。研究表明,将疫苗佐剂包在癌细胞膜中是一种有效的提高抗癌免疫的方法,为肿瘤免疫治疗提供了巨大的空间。 某些外毒素和内毒素化合物能够结合特定的细胞表面分子,这种性质可以被用于解毒。细胞膜包覆的纳米粒在体内作为毒素诱饵,吸收破坏毒素,减少毒素对正常细胞的侵袭。目前,细胞膜包裹的纳米粒已被应用于中和特定细菌毒素的新策略。 天然细胞膜的独特性质,包括其延长循环时间、免疫逃逸、粘附和同源靶向性的能力,为细胞膜仿生技术在纳米医学领域的新应用打开了大门。该技术中使用的细胞膜类型包括红细胞膜、血小板膜、白细胞膜、癌细胞膜、干细胞膜、β细胞膜、成纤维细胞膜及其杂化膜。这些细胞膜包裹的纳米粒已被证明可以实现有效的药物递送、肿瘤治疗、免疫调节和解毒。杂化细胞膜的出现使得各种细胞膜类型的特性得以融合,这种策略在过去两年中得到了广泛的应用。然而,目前与细胞膜仿生技术相关的研究还存在局限性。为了开发多功能智能细胞膜包裹纳米粒,不可避免地需要对膜进行某些修饰,同时可能会产生一定的副作用。过量使用免疫细胞膜包裹的纳米粒可能通过与免疫系统的相互作用诱发或加重炎症,从而可能导致病理介质的释放。虽然细胞膜仿生技术尚未实现全面的临床实施,但其明显的优势和丰富的细胞膜来源为其工业化生产提供了坚实的基础。作者相信,在不久的将来,细胞膜包裹纳米粒的研究和开发将为人类健康做出不可估量的贡献。 陈桐楷 (本文通讯作者) 广州中医药大学 副教授,硕士生导师 ▍主要研究成果 刘威 (本文通讯作者) 武汉大学 教授,博士生导师 ▍主要研究成果 撰稿:原文作者 编辑:《纳微快报》编辑部 E-mail:editorial_office@nmletters.org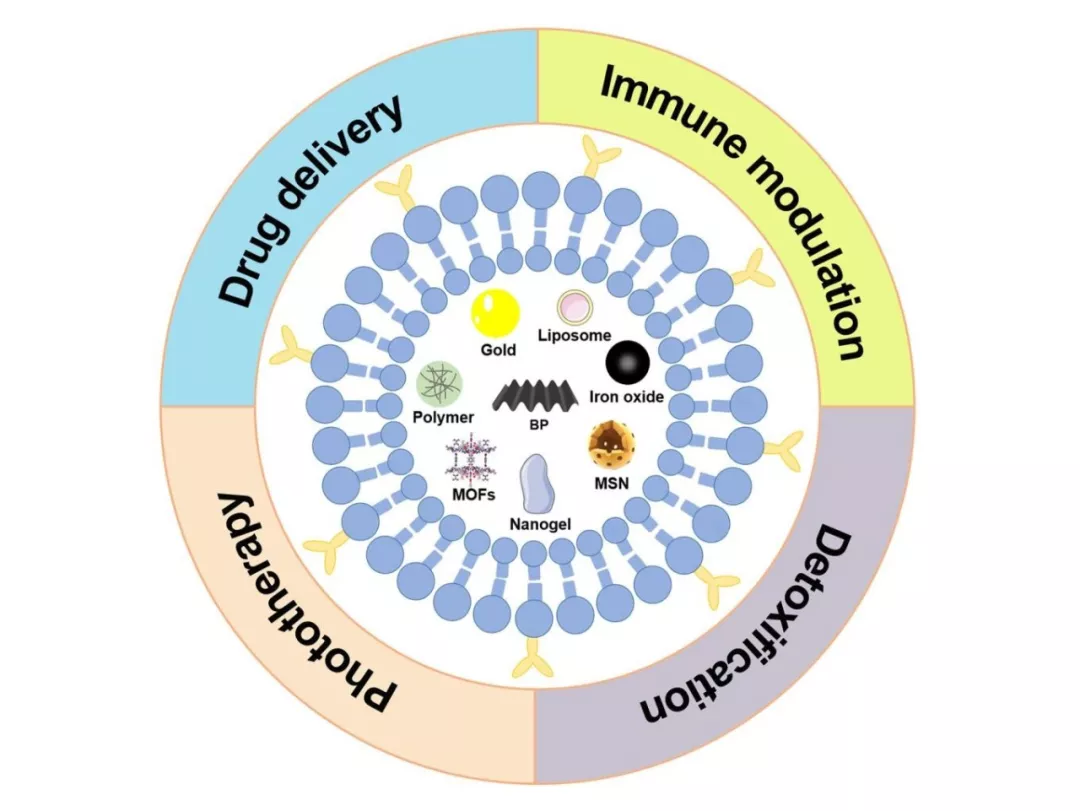



https://wap.sciencenet.cn/blog-3411509-1210250.html
上一篇:可穿戴可充电的水系钠离子电池:正负极均告别粘结剂
下一篇:综述:细胞纳米力学研究之”利器”—软体驱动器