在生物化学家Richard L.Veech教授 (1935-2020) 发现脂肪酸氧化过程的中间代谢产物酮体——β-羟基丁酸 (β-hydroxybutyrate, β-OHB) 后的很长一段时间,β-OHB都被简单地认为是饥饿应激下将能量从肝脏转移至外周组织的功能载体。然而事实上,β-OHB同时也是生命体内重要的信号分子和表观遗传调控分子,调节着生命功能的方方面面。比如,β-OHB一方面可以通过直接影响细胞内乙酰辅酶A (acetyl-CoA)、琥珀酰辅酶A (succinyl-CoA)、NAD+的含量或是抑制组蛋白去乙酰化酶 (HDAC) 活性,从而改变蛋白质的乙酰化、琥珀酰化修饰水平以及其他下游分子事件,调控细胞功能。
2016年,芝加哥大学赵英明教授团队发现,β-OHB可以使一些饥饿相关基因组蛋白上的赖氨酸发生3-羟基丁酰化修饰 (lysine β-hydroxybutyrylation, Kbhb),帮助机体快速调整并适应能量供应缺乏引起的代谢变化[1] (点击查看原文)。随后研究还陆续发现,除了组蛋白,β-OHB也可以修饰非组蛋白,参与癌症等疾病调控:2019年,北京大学基础医学院赵文会教授团队与景杰生物合作证明 [2],抑癌蛋白质p53在CBP催化下发生Kbhb后,引起p53乙酰化修饰水平及活性的显著降低,最终促进了癌症细胞的生长(点击查看原文)。2021年,研究首次发现【2】,MTA2可以通过R环结构反式调节BDH1介导的组蛋白3-羟基丁酰化修饰,并促进肝癌干细胞增殖(点击查看原文)。
2021年8月5日,来自来自美国加州大学尔湾分校(UCI)的Paolo Sassone-Corsi 教授团队,在Cell子刊Cell Reports上,在线发表了题为“Ketogenesis Impact on Liver Metabolism Revealed by Proteomics of Lysine β-hydroxybutyrylation” 的研究文章 [3]。他们利用特异性抗体及3-羟基丁酰化修饰组学技术,纵览了小鼠肝脏、肾脏蛋白质Kbhb水平在不同β-OHB含量情况下发生的改变,在此基础上,发现3-羟基丁酰化修饰可以直接抑制甲硫氨酸循环关键限速酶AHCY的活性,进一步揭示了3-羟基丁酰化修饰在生理病理过程中所扮演的角色。景杰生物为此项研究提供了特异性抗体产品和技术支持。
研究人员首先利用kbhb修饰泛抗体 (景杰生物,PTM-1201) 检测了小鼠各组织总蛋白的Kbhb水平,发现小鼠禁食48小时后,血液中β-OHB水平显著升高,与此同时,肝脏蛋白质的Kbhb水平也随之增强,重新喂食小鼠后,Kbhb则恢复至禁食初期水平;类似地,肾脏蛋白质Kbhb也在禁食后明显增强。然而,胰腺、骨骼肌、直肠、脑皮层、心脏蛋白质Kbhb则未随着饥饿应激而发生明显改变,表明β-OHB对蛋白质Kbhb的影响具有组织特异性。不仅如此,体外细胞系 (小鼠HEP1C、MEF, 人HEK293T) 的全蛋白Kbhb水平也随着β-OHB浓度的升高而增强。
图1 β-OHB对小鼠各组织及体外细胞系全蛋白Khbh水平的影响生酮作用产生的主要是β-OHB,那么,理论上其他促进酮体生成的生理/病理状态都会引起蛋白质Kbhb的增强。于是,研究人员通过两种方式:1. 生酮饮食喂养小鼠;2. 注射致糖尿病剂量的链脲霉素,以促进小鼠体内的生酮作用。这两种方式都使得小鼠血液中β-OHB含量明显升高,继而引起肝脏、肾脏蛋白质Kbhb的水平增强。重要的是,和饥饿应激结果相似,生酮饮食也只是组织特异性地促进了肝脏、肾脏蛋白质Kbhb水平。图2 生酮饮食、链脲霉素导致的β-OHB升高对小鼠各组织蛋白质Khbh水平的影响
接下来,研究人员利用3-羟基丁酰化修饰组学技术(质谱策略),在饥饿小鼠肝脏(样本策略)中共检测到了267个蛋白质共891个赖氨酸位点发生了3-羟基丁酰化修饰,这其中,82.8%的蛋白质和72.4%赖氨酸位点也可以发生乙酰化修饰。亚细胞定位分析表明,β-羟基丁酰化修饰蛋白质广泛分布于胞浆、线粒体、细胞核中,暗示β-羟基丁酰化修饰对细胞功能的广泛影响。通过修饰位点分析,研究人员发现,114个蛋白质 (42.7%) 只有一个Kbhb位点,然而,许多关键的代谢酶则有多达超过10个的Kbhb位点。比如说,尿素循环限速酶CPS1和生酮作用限速酶HMGCS2则分别含有35个、15个Kbhb位点,这些Kbhb位点与对酶功能重要的赖氨酸残基重叠,使Kbhb具有调节酶活性的潜力。GO分析也显示,Kbhb富集于许多肝脏核心代谢通路中(包括三大营养物质代谢,谷胱甘肽代谢,一碳代谢等),和细胞解毒途径(特别是对活性氧和氧化应激的反应、过氧化氢分解代谢和氧化还原稳态中)。
图3 3-羟基丁酰化修饰组学技术鉴定小鼠肝脏蛋白质Kbhb有意思的是,研究人员注意到甲硫氨酸代谢过程中的诸多代谢酶都发生了Kbhb,于是接下来,他们着重研究了β-OHB对催化S-腺苷甲硫氨酸 (SAH) 产生同型半胱氨酸 (HCY) 的水解酶AHCY (S-adenosyl-L-homocysteine hydrolase, AHCY) 活性的影响。研究人员在MEF细胞中过表达AHCY后,利用特异性抗体发现,AHCY Kbhb水平在Na-β-OHB孵育8小时后显著增强,此外,饥饿应激与生酮饮食都可以增强AHCY Kbhb。重要的是,通过检测底物浓度以指征AHCY活性,研究人员发现Na-β-OHB孵育8小时对AHCY的活性抑制也最为明显,表明β-OHB可通过3-羟基丁酰化修饰作用抑制AHCY活性。随后,通过对AHCY结构分析以及Kbhb位点突变,研究人员证实Kbhb在多个位点(包括K389、K405和K188)可能产生协同效应,最终共同作用抑制AHCY活性。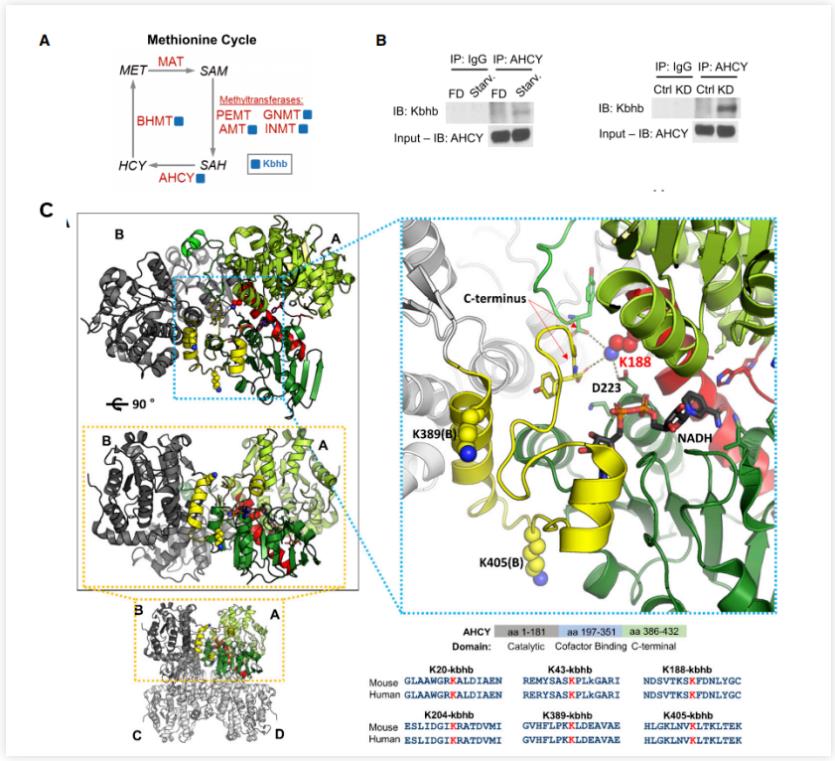
本文中,研究人员利用β-羟基丁酰化修饰特异性泛抗体首次系统性地研究了小鼠多种器官/组织蛋白质Kbhb情况,并利用饥饿应激、生酮饮食等多种促进生酮作用的方法,调查了生理和病理状态下,β-OHB对蛋白质Kbhb的影响。重要的是,利用3-羟基丁酰化修饰组学技术,研究人员也发现了Kbhb富集于多种关键肝脏代谢过程,结合结构分析、位点突变,详实地论证了Kbhb对AHCY的抑制作用。考虑到肿瘤细胞的增殖高度依赖一碳代谢过程,并且有报道指出AHCY是肿瘤治疗的潜在靶点。因此,结合本项研究的证据,很有可能意味着,在未来可以通过生酮饮食提高体内β-OHB水平,增强AHCY Kbhb修饰水平,以起到抑制甲硫氨酸代谢、抑制肿瘤增殖的作用。
1. Zhongyu Xie et al., 2019. Metabolic Regulation of Gene Expression by Histone Lysine β-hydroxybutyrylation. Molecular Cell.2. Kun Liu, et al., 2019. p53 β-hydroxybutyrylation attenuates p53 activity. Cell Death & Disease. 3. Heng Zhang, et al., 2021, MTA2 triggered R-loop trans-regulates BDH1-mediated β-hydroxybutyrylation and potentiates propagation of hepatocellular carcinoma stem cells. Signal Transduction and Targeted Therapy.4. Kevin B. Koronowski, et al., 2021. Ketogenesis Impact on Liver Metabolism Revealed by Proteomics of Lysine β-hydroxybutyrylation. Cell Reports.
https://wap.sciencenet.cn/blog-3404471-1300629.html
上一篇:
Analytical Chemistry | 宏修饰组学揭示肠道菌群酰化修饰调控"秘密"下一篇:
EES | 华中农业大学首次报道琥珀酰化在昆虫趋光行为中重要作用





