博文
Mol Cell丨吕志民团队揭示琥珀酰化介导的肿瘤细胞氧化应激调控新机制
|
蛋白质琥珀酰化修饰 (succinylation) ,作为赖氨酸酰化修饰家族的重要一员,于2011年由芝加哥大学赵英明教授团队在Nature Chemical Biology 发文被首次报道,并被评为该杂志创刊10年39篇精品论文之一 [1]。随后,关于琥珀酰化的调控酶系统(转移酶writer和去修饰酶eraser)和生物学功能也有了越来越多的报道。如浙江大学转化医学研究院吕志民教授课题组在Nature发文,首次发现了组蛋白琥珀酰化修饰的转移酶——KAT2A,可以调节组蛋白H3K79位点琥珀酰化 [2]。在细胞多层面功能的调控机制中都发现了琥珀酰化修饰发挥着举足轻重的作用。
谷氨酰胺(Gln)是人体内含量最丰富的氨基酸,也是肿瘤细胞生长所必需的氨基酸。谷氨酰胺酶(GLS)是谷氨酰胺代谢的关键酶,它将谷氨酰胺转化为谷氨酸,分解产生α-酮戊二酸,进入三羧酸循环中代谢而提供能量。GLS具有致癌特性,GLS对基因组和表观基因组选择性的干预影响癌症的代谢重编程,被认为是一个有价值的肿瘤治疗靶点,靶向GLS的药物现已进入临床试验。然而,GLS具体调控机制,尤其是是否在翻译后修饰被调控以支持肿瘤细胞生长仍存在诸多未知。
2021年5月14日,浙江大学转化医学研究院吕志民教授和中国海洋大学于日磊教授(共同通讯作者)合作在Molecular Cell 上发表题为SUCLA2-coupled regulation of GLS succinylation and activity counteracts oxidative stress in tumor cells的文章。该项研究揭示了GLS上的一种新型翻译后修饰——琥珀酰化,并发现肿瘤细胞在氧化应激条件下,通过SUCLA2调控 GLS的琥珀酰化和酶活性,进而增强谷氨酰胺代谢水平。该研究强调了蛋白质功能的改变可以通过修饰蛋白质与代谢酶及其代谢底物和产物的相互作用来调节,并将为肿瘤治疗新策略的开发提供新思路。

一、GLS在人胰腺导管腺癌中上调
胰腺导管腺癌(PDAC)细胞使用谷氨酰胺进行合成代谢过程。为了检测GLS在PDAC中的表达水平,研究人员对54例人PDAC标本及其配对的正常人胰腺组织进行了免疫组化分析,证实了GLS在PDAC组织中高表达。谷胱甘肽胺剥夺、特异性GLS抑制剂处理、及shRNA处理沉默GLS基因,对PDAC细胞增殖抑制作用大于对正常人胰管上皮(HPDE)细胞的抑制作用,表明GLS在PDAC细胞中高表达,其增殖依赖于谷氨酰胺代谢。

图1 GLS在PDAC中高表达,促进PDAC细胞增殖
二、GLS K311琥珀酰化增强了GLS的聚合和活性
研究进一步发现,除了调节其表达水平外,GLS还可以通过翻译后修饰调控其活性。GLS在进化上保守的K311位点处发生琥珀酰化,琥珀酰辅酶A可以在线粒体中和体外调控GLS的琥珀酰化。运用抗赖氨酸琥珀酰化泛抗体和特异性抗GLS K311琥珀酰化抗体(K311succ)检测,发现rGLS K311R突变体的琥珀酸化程度远远低于其WT对应物,这些结果表明GLS主要在K311被琥珀酰化。PDAC细胞中,GLS K311琥珀酰化促进GLS聚合,这可能是由于相邻单体的琥珀酰化K311和H475之间形成氢键,导致GLS活性随后增强。
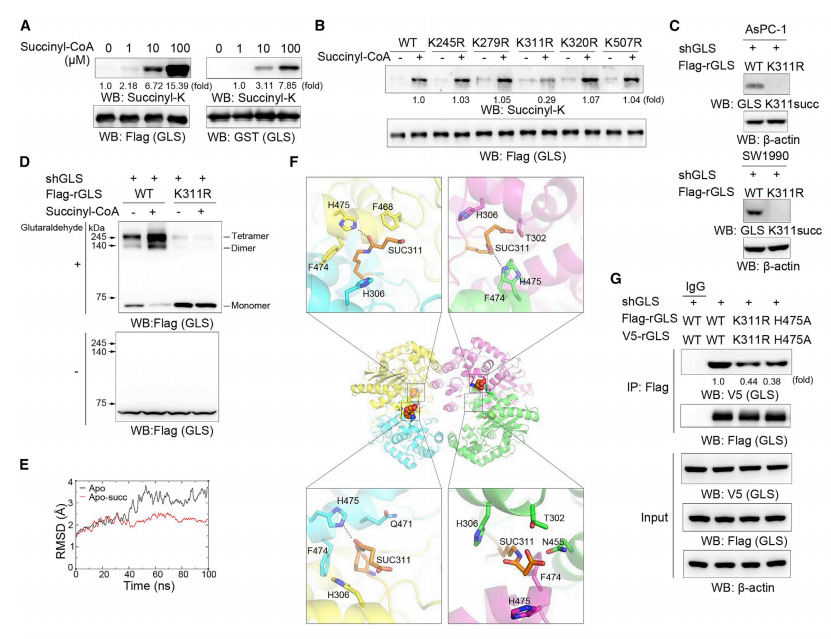
图2 GLS K311琥珀酰化导致GLS活性增强
三、p38磷酸化SUCLA2与GLS解离并促进GLS K311琥珀酰化
为了确定GLS K311琥珀酰化的调控机制,研究人员对GLS免疫沉淀物进行了质谱分析。琥珀酰辅酶a合成酶SUCL是由SUCLG1编码的不变性亚基a和由SUCLA2编码的底物特异性亚基b组成的异源二聚体酶,可以将琥珀酰辅酶A分解为琥珀酸和辅酶A,同时产生ATP。结果表明SUCLA2(而不是SUCLG2),与GLS相互作用和共定位。只有SUCLA2(而不是SUCLG2)的缺失增强了GLS K311的琥珀酸化,这表明调节GLS和SUCLA2之间的联系有助于GLS K311的琥珀酸化。
质谱分析进一步发现,氧化应激条件下,p38被激活,使SUCLA2 S79磷酸化,促进了SUCLA2(而非SUCLG2)与GLS的解离。阻止SUCLA2介导的琥珀酸辅酶A转化为琥珀酸,导致GLS 周围局部琥珀酰辅酶A水平的升高,从而促进GLS的琥珀酰化和聚合。值得一提的是,鉴于Lys可以乙酰化和泛素化,研究人员检测了氧化应激条件下GLS K311琥珀酰化、乙酰化和泛素化的水平,结果表明GLS K311主要发生琥珀酰化修饰的改变,而不是乙酰化或泛素化的。
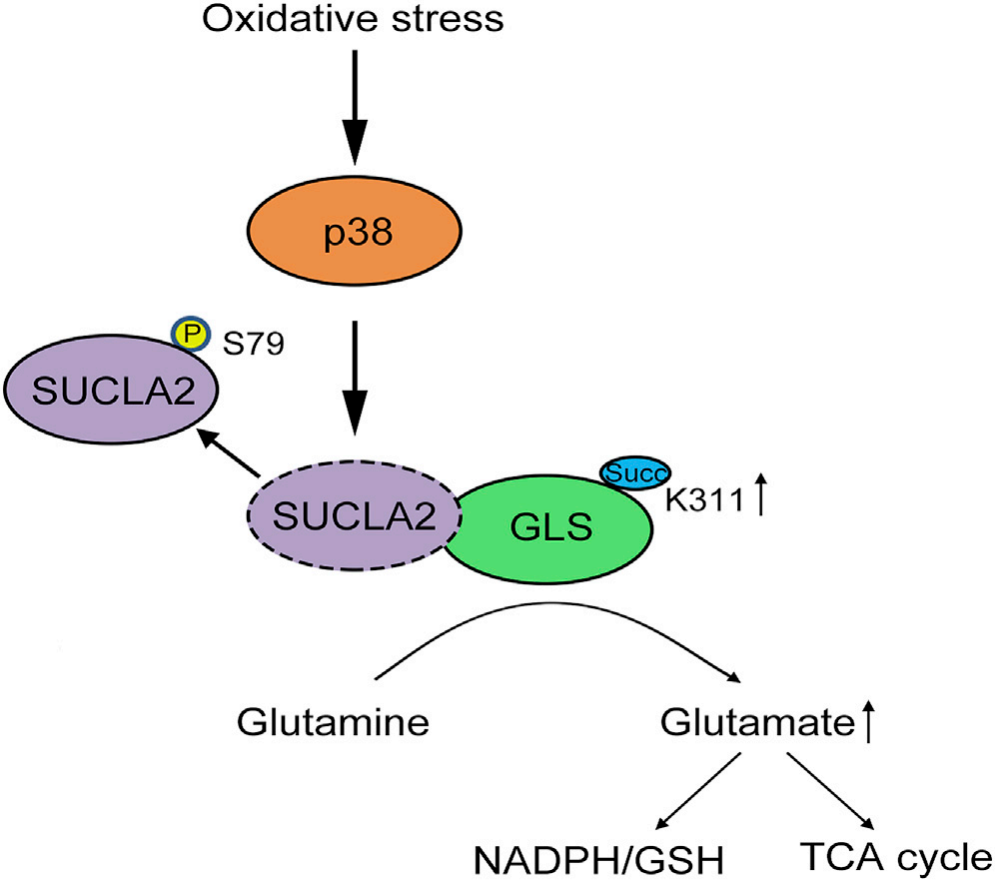
图3 SUCLA2 S79磷酸化促进了细胞氧化应激时SUCLA2与GLS的解离
四、GLS琥珀酰化促进谷氨酰胺分解和肿瘤生长
研究进一步探讨了SUCLA2 S79磷酸化调节的GLS K311琥珀酰化对谷氨酰胺代谢、氧化应激和肿瘤发展中的调控。结果表明SUCLA2调节的GLS激活在抗氧化应激中起着关键作用,GLS K311琥珀酰化和活化促进谷氨酰胺代谢,导致NADPH和谷胱甘肽的产生,以对抗氧化应激诱导的ROS产生和凋亡,并促进小鼠肿瘤细胞增殖和肿瘤生长。在临床样本中也发现,SUCLA2 pS79和GLS K311琥珀酰化水平呈正相关,与胰腺导管腺癌患者的临床分期和不良预后呈正相关。这些结果支持SUCLA2 pS79调控的GLS K311琥珀酰化在人PDAC临床侵袭性中的关键作用。
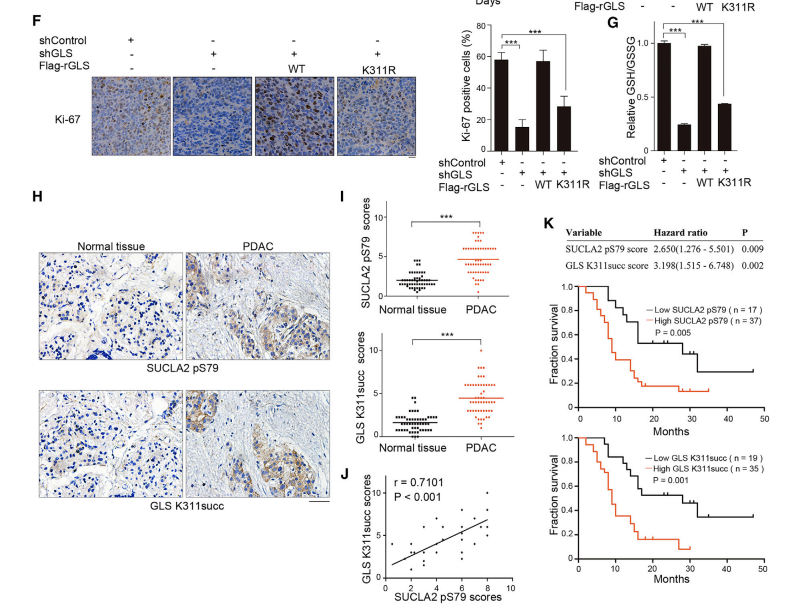
图4 GLS K311琥珀酰化促进小鼠肿瘤细胞增殖和肿瘤发展
综上所述,本研究揭示了一个全新的GLS调节机制——琥珀酰化介导的GLS活性调控,并发现肿瘤细胞在氧化应激条件下,通过SUCLA2调控 GLS的琥珀酰化和酶活性,促进谷氨酰胺代谢,在细胞凋亡、肿瘤增殖中起重要作用。研究证实了GLS K311琥珀酰化与人PDAC的临床侵袭性相关,强调了干预GLS琥珀酰化对于癌症治疗策略的可能性。
参考文献
1. Zhihong Zhang, et al., 2011. Identification of lysine succinylation as a new post-translational modification. Nature Chemical Biology.
2. Yugang Wang, et al., 2017. KAT2A coupled with the α-KGDH complex acts as a histone H3 succinyltransferase. Nature.
3. Yingying Tong, et al., 2021. SUCLA2-coupled regulation of GLS succinylation and activity counteracts oxidative stress in tumor cells. Molecular Cell.
https://wap.sciencenet.cn/blog-3404471-1289359.html
上一篇:I类HDACs是乳酸化修饰“eraser”
下一篇:【热点跟踪】20+分Nature子刊三连发,PWAS技术再揭抑郁症新靶标