博文
Sci Transl Med封面 | 蛋白质组学揭示多囊肾病的发病重要机制
|
常染色体显性多囊肾病(ADPKD)是一种常见的遗传性肾脏疾病,该疾病主要是由PKD1或PDK2基因突变所致,进而引发大量双侧肾囊肿以及最终进行性肾衰竭,影响了全球1250万人的健康。
有研究表明,线粒体功能障碍是ADPKD的主要特征,线粒体功能受损会导致活性氧(ROS)的生成,ROS产生和清除之间的不平衡会导致氧化应激,从而引发组织损伤和功能障碍。ADPKD中抗氧化酶的减少和氧化损伤的增加表明ADPKD的进展与过度的ROS以及氧化应激的增加有关。尽管已经有了一定的研究基础,但是ADPKD疾病发展的分子机制目前仍然不是很清楚。
2020年7月29日,天津医科大学陈宇鹏、张丽荣团队与山东省立医院熊晖团队合作在Sci Transl Med(IF=16.304)上发表了题为Activationof NRF2 ameliorates oxidative stress and cystogenesis in autosomal dominantpolycystic kidney disease的研究论文,研究者运用蛋白质组学技术揭示了NRF2抗氧化通路的受损是氧化应激和囊肿形成的关键因素,并揭示了NRF2激活其靶基因的调控机制,相关研究成果在该杂志以cover story的形式展示。这篇研究不仅揭示了ADPKD的发病机制,同时也为未来临床上ADPKD的治疗提供指导意义。景杰生物为该研究中的蛋白质组学结果提供技术支持。
1. ROS的积累与ADPKD的疾病进展呈正相关
蛋白质组学是系统研究各种生理病理条件下蛋白表达丰度的强大技术工具。为了更好的探究ADPKD疾病进展的分子机制和潜在治疗靶标,作者利用TMT标记定量蛋白质组学技术(质谱策略)对WT小鼠以及PKD1敲除小鼠(ADPKD小鼠疾病模型)的肾脏组织(样本策略)进行分析,共鉴定到5100个蛋白。相较于WT组,ADPKD组有 789个蛋白上调,上调蛋白主要参与炎症应答、细胞代谢、胶原合成以及MAPK级联激酶信号等过程;569个蛋白下调,下调蛋白主要富集氧化还原酶活性和电子传递链等通路,并且有三分之一下调的蛋白定位在线粒体。蛋白质组学分析揭示了ADPKD小鼠肾脏中线粒体功能缺陷以及与氧化还原信号关联。
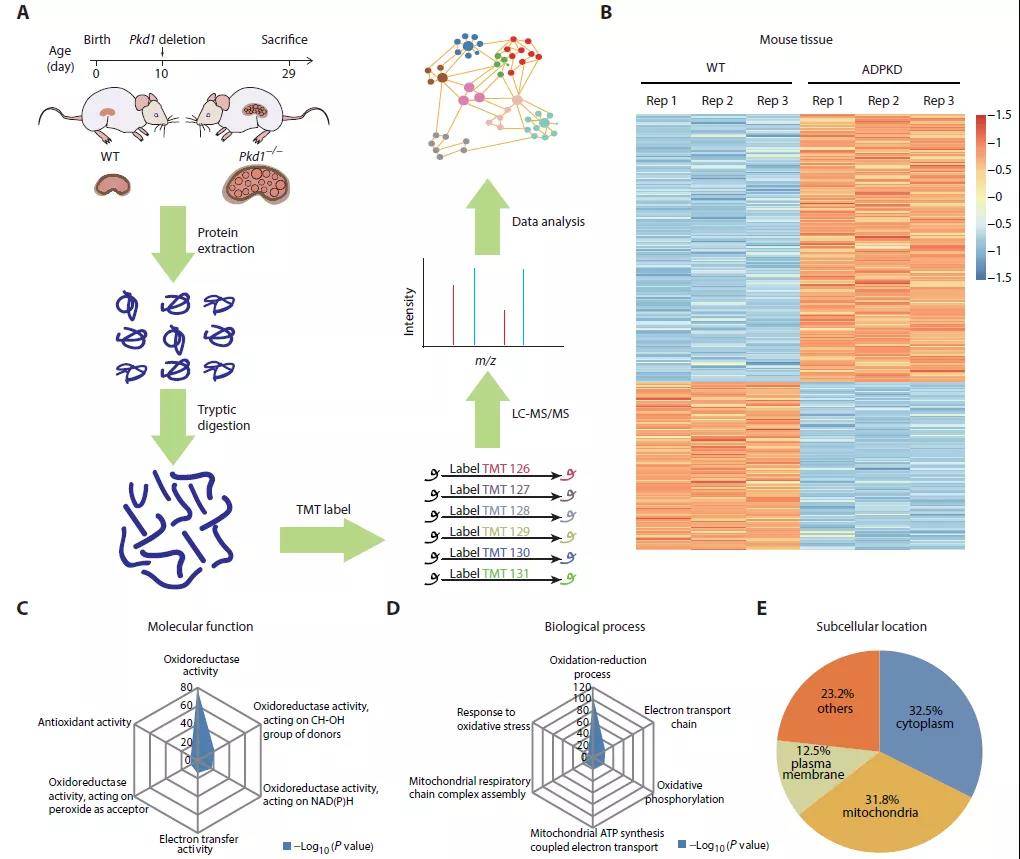
图1 ROS的积累与ADPKD的疾病进展密切关联
2. ADPKD肾脏中NRF2抗氧化通路功能受损
NRF2被公认为是细胞防御氧化应激的主要调节剂,NRF2通过转录活化细胞保护基因的表达进而减轻各种肾脏疾病中的氧化损伤和炎症来发挥保护作用,包括急性肾脏损伤,慢性肾脏疾病和糖尿病等。接下来作者关注了NRF2信号通路的活性,对NRF2靶向的38个蛋白进行鉴定并定量,结果显示ADPKD小鼠肾脏中60%靶向的蛋白显著下调。Western Blotting结果显示ADPKD小鼠肾脏组织中NRF2的表达降低。以上结果揭示了ADPKD小鼠肾脏NRF2抗氧化活性信号通路的损伤可能与疾病进展相关。
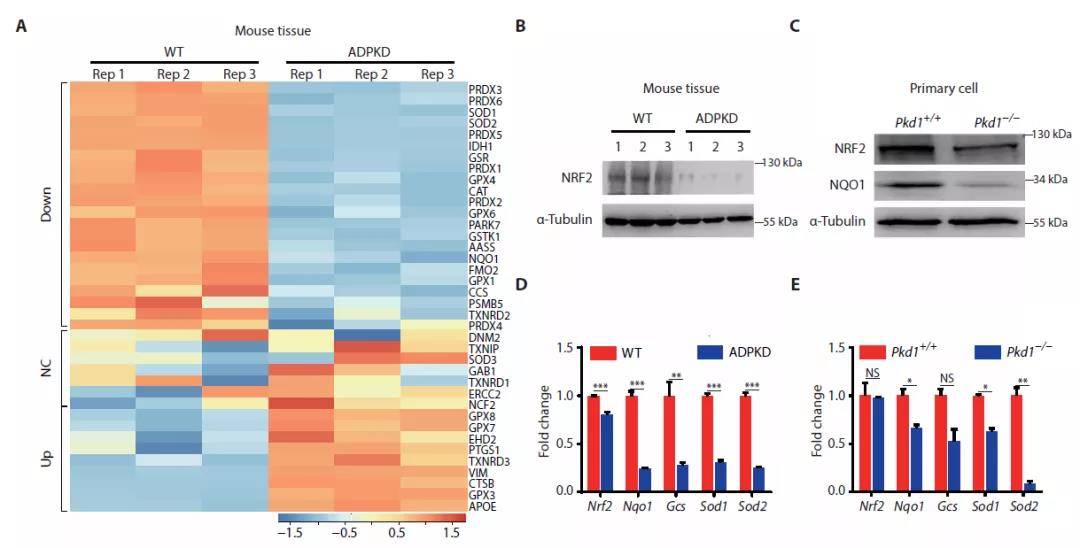
图2 ADPKD肾脏中NRF2抗氧化通路功能受损
3. Nrf2敲除会增加氧化损伤并加速ADPKD囊肿发生
为了进一步探究NRF2在体内ADPKD疾病进程中的功能,作者对Nrf2敲除小鼠和Pdk1敲除小鼠进行杂交并在诱导肾脏囊肿发生后收集小鼠肾脏进行实验。在具有功能性Pkd1的小鼠中,Nrf2缺失与否均不会导致肾脏大小、肾脏重量与体重比、血尿素氮(BUN)的明显异常。但是在Pkd1缺失的小鼠中,Nrf2敲除会导致肾脏明显变大、肾脏与体重比更高、BUN和血清肌酐浓度更高以及囊肿形成增加。以上这些结果表明,NRF2的缺失加剧了ADPKD进程。
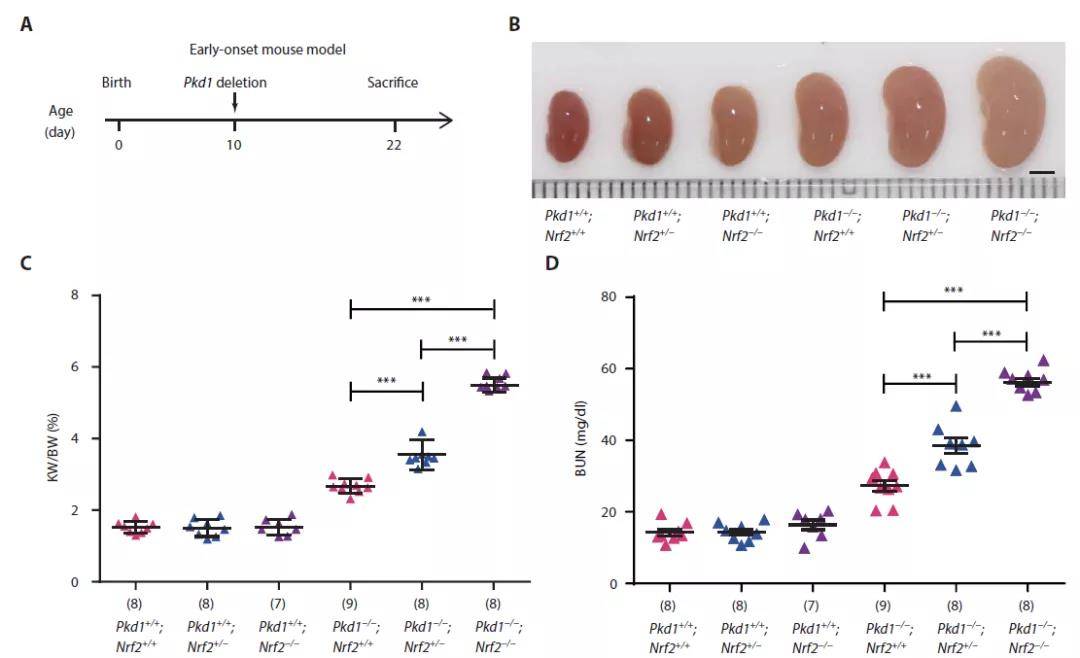
图3 Nrf2敲除增加氧化损伤并加速ADPKD囊肿发生
4. NRF2活化改善氧化损伤和ADPKD囊肿发生
鉴于作者观察到NRF2在ADPKD中下调并且Nrf2缺失会使ADPKD恶化,因此作者假设诱导NRF2表达可以抑制疾病进展。Sulforaphane(SFN)是一种可以促进NRF2核积累的天然化合物,作者通过实验发现,ADPKD小鼠模型中SFN处理会降低发病肾脏大小、囊性指数以及ROS累积并促进肾脏功能。因此,SFN可能通过NRF2途径降低了肾脏组织中的氧化应激并减弱了ADPKD发病进展。
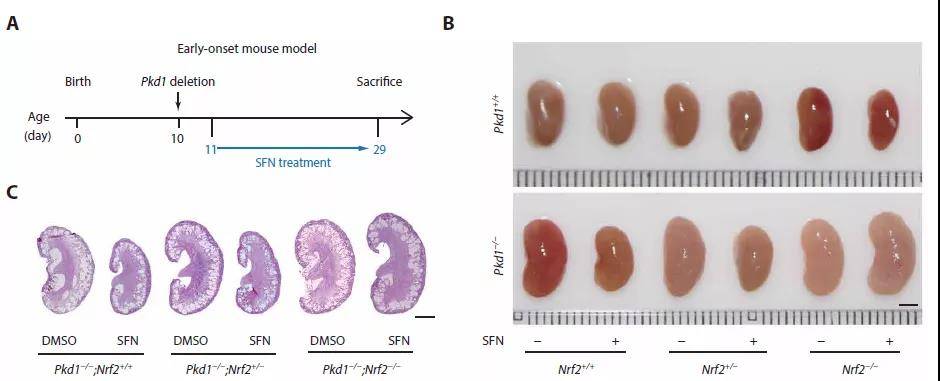
图4 NRF2活化改善氧化损伤和ADPKD囊肿发生
氧化应激是常染色体显性多囊肾病(ADPKD)发病进程的关键因素,但是囊性细胞中氧化还原稳态失衡的分子机制目前仍不清楚。本篇研究发现NRF2抗氧化途径的活性受损是氧化损伤和ADPKD进程的主要机制。通过定量蛋白质组学技术结合生化分析,研究者发现NRF2蛋白降解的增加抑制了ADPKD小鼠肾脏中NRF2抗氧化途径。在一组临床ADPKD患者样本中,活性氧(ROS)的积累与NRF2丰度呈负相关,与疾病的严重程度呈正相关。进一步的研究表明,NRF2的药理诱导降低ROS的产生并减慢了囊肿形成和疾病的发展。综上,本篇研究不仅揭示了ADPKD的发病机制,同时也为未来临床上ADPKD的治疗提供指导意义。
参考文献:
1. Yi Lu, et al. 2020. Activation of NRF2 ameliorates oxidative stress andcystogenesis in autosomal dominant polycystic kidney disease. Sci Transl Med.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿、等其他合作需求,请文章下方留言,或添加微信ptm-market咨询
https://wap.sciencenet.cn/blog-3404471-1247312.html
上一篇:中山大学邓蓉/朱孝峰/唐军组合作揭示自噬介导的三阴性乳腺癌的免疫逃逸机制
下一篇:最一致的AD信号,超深度蛋白质组证实线粒体蛋白可作为阿尔茨海默症的新标志物