博文
气液可连续转变------Andrews的伟大发现
||
初中物理里就讲物质有固态,液态,气态等三态。大家熟悉的化学式为H2O的物质即可以呈现这三种仿佛截然不同的状态;其在固态时被称为冰,在液态时被称为水,在气态时被称为水蒸汽。
物质从液态到气态,性质似乎一般会发生巨大变化。以H2O为例,水与水蒸汽密度差了几百甚至上千倍,二者对压力的响应也有明显差别,水是很难被压缩的,但是水蒸汽跟空气一样很容易被压缩(所以炸弹在水下爆炸比在空气中爆炸威力大得多,杀伤半径大得多)。此外,在从水到水蒸汽的过程中,外界需要提供大量的热(所以微风即可让人感到凉爽)。所有这些因素均给人以印象,即物质的液态与气态是本质上不同的两个形态。
进入近代,人们开始大量研究物质对温度和压力的响应后,又发现了液相与气相新的差异,即气相比液相简单得多。物质在气相时的状态方程相对比较简单,一般比较符合波义耳定律和马略特定律,而在液相时就没有明显而简单的规律了。
可是,在1869年,英国科学家Thomas Andrews宣布,其实气相与液相本质是一个相,二者之间可以连续转变。他的文章的标题精炼得当,on the continuitiy of the gaseous and liquid states of matter。这里的“连续”的意义是这样的。通常大家想象中的气液转变是个存在相分离(或者说两相共存)的过程,整个系统不均匀,部分处在高密度的液态,部分处在低密度的气态。这两部分此消彼长,完成彻底的气化或者液化过程。但是,Andrews指出,其实我们完全可以让系统从任意一个大家公认的气态经过一系列中间状态到达任意一个大家公认的液态,而在整个过程中,系统至始至终处于均匀的状态(不发生相分离)。
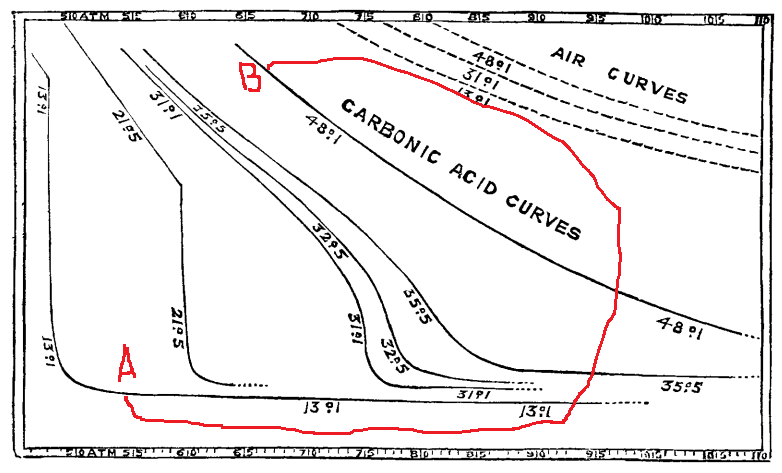
Andrews能够做出这个伟大发现(愚以为可以得奖),在于他找了一个正确的材料,做了一件单调但是系统的事情,即测量二氧化碳的等温曲线。他文章的原图如下:
每条曲线均标注有摄氏温度,坐标横轴为压强,纵轴为体积。可以看到,在温度比较低的时候,比如在温度为21.5度时,曲线存在明显的峭壁(按照现在的习惯,横轴会取体积,纵轴会取压强,就会是平台结构)。这对应着通常的气液转变。但是,在更高的温度下,比如在温度为48.1度或者35.5度时,峭壁就消失了。事实上,我们看到,在温度从13.1度逐步升高到48.1度的过程中,曲线的峭壁部分逐渐减小,大概在31.1度时,其完全消失。Andrews把这个温度称为临界温度(critical temperature)。注意纵轴代表体积,所以峭壁部分的消失,意味着随着温度提高,共存的气液两相的密度差逐步趋于零以致消失。
在临界温度之上,物质不再发生所谓的气液转变,永远保持为均匀的单相,这个单相的两端分别是密度低容易压缩近似为理想气体的所谓的“气态”和密度大难以压缩的所谓的“液态”。
从图中,我们也清楚地看到,任意通常被认为是液态的A状态可以通过一条绕过临界点的路径迂回地与任意通常被认为是气态的B状态连接起来,此即Andrews所谓的气液连续性。他自己在实验上做过这样的操作。
也许Andrews成功的一个重要因素是他选对了材料。二氧化碳的临界温度在室温范围!其相应的临界压强也只有74个大气压,这都在当时的实验能力之内。相比之下,水的临界温度高达374度,而临界压强则是220个大气压。用水做类似实验危险得多。
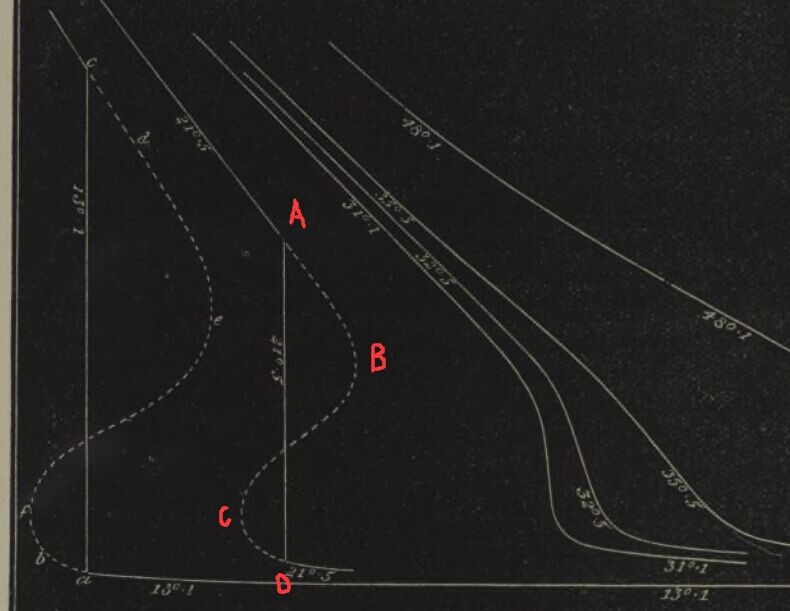
Andrews的发现的影响直接而巨大。1870年,James Thomson发表了题为considerations on the abrupt change at boiling or condensation in reference to the continuity of the fluid state of matter的文章。观察andrews的文章里的实验曲线,james thomson觉得那些峭壁也许应该被更光滑的曲线替代。见下图虚线:
以图中温度为21.5度的曲线为例,他认为系统在从上往下走时(即体积减小),在A点不一定要突然改变方向沿AD方向走,而是可以保持原来方向沿着AB走。整个等温曲线完全可以是一条光滑曲线,不出现任何cusp。
James Thomson的观点很有意思。
不过,在后人看来,这也许是抛砖引玉。
仅仅三年后,荷兰人van der walls的方程横空出世! van der walls是在其博士论文里提出他的方程的。Andrews对他的影响清楚地显示在他的博士论文标题上。他的标题是,on the continuity of the gas and liquid state,跟andrews的论文标题几无二致!事实上他要达成的目标也跟andrews一致------既然气液两相本质为一相,那就找一个方程把它们一石二鸟一网打尽。
已经对andrews的发现无比钦佩的maxwell(在他的1973年出版的热学专著the theory of heat里,maxwell大篇幅介绍了andrews的发现)被van der walls的工作震惊了。他在nature上发文,高度赞扬了van der walls的工作,以至于他说,it has certainly directed the attention of more than one inquirer to the study of the low-Dutch language in which it is written.
附带地,maxwell给出了所谓的maxwell construction。之前james thomson认为等温曲线应该是光滑的,现在van der walls方程确实能够给出光滑的曲线,但是却不知道如何确定那段峭壁所在位置。maxwell基于热力学给了一个方案。
注1:刘全慧老师有次在批评某教材时讲,好的文章好的教材的文字是有一股张力的。读andrews的文章,james thomson的文章,maxwell的文章,maxwell的教材时,我感受到了这种张力。尤其是andrews的文章,他下论断时掷地有声。他们的文章在此:
注2:值得注意的是,andrews在文章结尾,曾表示固体与液体是否能够连续转变是个值得研究的问题。今天,我们知道,固液不能连续转变,因为对称性不能连续变化。
注3:有个问题我问过很多做实验的人,但是都没有得到答案。在实验室,氮气瓶很常见。氮气瓶肯定不能完全封闭,不然经过热传导,里面的氮迟早会达到室温,这样的氮也就无法用于低温实验。除此之外,这个温度远远高于其临界温度,会导致里面的压强巨大,在应用上不安全。所以,氮气瓶应该是一个设置了一个阀门的杜瓦瓶,外界热量缓慢地传入瓶内,引起蒸发,在里面的气体的压强超过阈值(不会很高)后就放气。通过蒸发吸热,保持里面的液氮在低温,但是付出的代价是漏气。现在的问题是,那些氮气瓶看起来都很粗糙,隔热效果不一定多好,不知道一瓶气多久跑完?
https://wap.sciencenet.cn/blog-100379-1113825.html
上一篇:你所不知道的以色列
下一篇:平壤打纽约,弹道导弹至少得多大速度?