博文
氢气对肝缺血损伤的治疗作用【经典】
|
氢气对肝缺血损伤的治疗作用【经典】
这是2007年发表的氢气医学论文,虽然简单甚至单薄,但和《自然医学》的论文是姊妹篇,采用类似的氢气吸入方法,证明氢气对肝脏缺血具有治疗作用。研究内容主要包括肝脏损伤病理学结果,肝功能和氧化应激测定。这篇论文也是促使我下决心开展氢气医学研究的重要因素,自然医学的那篇论文给我的影响是震撼,但让我一下接受不了,因为我对氢气在潜水医学方面的应用非常熟悉,但我不了解其生物医学作用,微量氢气具有治疗疾病的潜在价值实在无法让人接受。但随后发表的这篇论文再次告诉我,日本团队对氢气治疗疾病的信念非常坚定,我们能从这相继发表的论文中感受到这种信念。既然如此,氢气治疗疾病的现象真实性比较高,因此推动了我们验证该效应的决心。2007年9月,我们团队就开展了这一研究,很快证明氢气微量吸入具有疾病治疗的作用。
Fukuda K, Asoh S, Ishikawa M, Yamamoto Y, Ohsawa I, Ohta S. Inhalation of hydrogen gas suppresses hepatic injury caused by ischemia/reperfusion through reducing oxidative stress. Biochem Biophys Res Commun. 2007 Sep 28;361(3):670-4.
活性氧(ROS)被广泛认为是与生活方式有关的疾病、癌症和衰老过程的原因之一。此外,当组织经历缺血再灌注时,ROS在再灌注的早期阶段大量产生,对包括肝脏[1]、大脑[2]、心脏[3]和肾脏[4]在内的各种器官的组织造成严重损害。长时间的肝脏热缺血加剧了再灌注后的氧化应激,导致严重的再灌注损伤[1];因此,由氧化应激引起的缺血再灌注损伤已成为基础和临床研究的主要焦点。
缺血再灌注引起器官损伤的最可能机制是多因素且相互依赖的,涉及缺氧、炎症反应和自由基损伤[5]、[6]。尽管缺血再灌注损伤的病因尚未明确定义,但氧自由基似乎在其中扮演重要角色[7]、[8]、[9]、[10]、[11]。因此,自由基清除剂被认为在缺血再灌注损伤的临床环境中是实用的。实际上,迄今为止已经尝试了许多试剂,如尼克拉文[12]、MCL-186[13]、MESNA[14]以及α-生育酚和GdCl3[15]作为预期能预防缺血再灌注损伤的清除剂。
我们最近证明了氢气在体外选择性地降低了羟基自由基的水平,并且使用大鼠中脑动脉闭塞模型证明氢气分子具有治疗性抗氧化活性[16];然而,目前尚不清楚像氦气这样的小分子是否具有类似的效果,以及这种方法是否适用于其他器官。在这里,我们展示了吸入氢气对缺血再灌注引起的肝损伤是有效的,而氦气则没有效果。
(非常直白,缺血再灌注损伤和氧化应激有关,最近我们发现氢气对大脑缺血再灌注损伤具有治疗作用,是和选择性抗氧化有关,肝脏释放也具有类似作用需要研究。)
材料和方法
雄性C57 BL/6N小鼠(4至5周龄,15-18克)购自Seac Yoshitomi有限公司。小鼠在标准条件下饲养,光照周期为12小时,可以随意进食标准啮齿动物食物和自来水。实验按照《实验室动物护理和使用指南》进行,并得到了日本医科大学动物护理和使用委员会的批准。
肝脏缺血再灌注模型。在全身麻醉下(用1.5%七氟醚的N2O/O2(70:30)混合气体,流速为1 L/min),对小鼠进行了缺血再灌注程序。所有实验中使用了部分肝缺血模型,如之前描述的[17]、[18]、[19]、[20]。简而言之,在腹部中线切口后,用微血管夹(FD562; Aesculap, South San Francisco, CA, USA)夹住通往左叶和左中叶肝脏的门脉三联(肝动脉、门静脉和胆管),以产生部分肝缺血。通过观察左侧肝脏颜色变浅来视觉上确认夹闭。用5.0尼龙缝线以简单连续的方式缝合腹壁肌肉和腹膜。经过90分钟缺血后,进行第二次剖腹手术以移除夹子。再次以相同的方式关闭腹部,随后进行180分钟的再灌注。
吸入氢气气体。为了给麻醉的小鼠提供氢气气体,氢气气体通过气流计TF-1(YUTAKA Engineering Corp., Tokyo, Japan)在再灌注前10分钟直到再灌注结束(总共190分钟)供应到麻醉气体(1.5%七氟醚的N2O/O2(70:30)混合气体;流速为1 L/min)中。使用呼吸气体分析仪™ Model TGA-2000(TERAMECS, Kyoto, Japan)测定麻醉气体中氢气气体的浓度。
样本收集。在再灌注结束时,取出缺血的肝脏(左叶)进行进一步实验,并用剃刀片从中间切成两半。一半立即在液氮中冷冻,并在-80°C下储存,直到确定丙二醛(MDA)水平。另一半进一步切成几片,并用4%的甲醛固定在0.1 M磷酸盐缓冲液(pH7.4)中,用于组织病理学研究。血液样本也从心脏中采集,以测量肝脏酶。
苏木精-伊红染色。固定的肝脏被脱水并嵌入石蜡中。组织被切片(厚度4微米)并用苏木精-伊红(HE)染色。
血清丙氨酸氨基转移酶活性。血液样本凝固后,在4°C下以3000 rpm离心5分钟。上层清液再次在相同条件下离心以制备血清。使用Transaminase CII Testwako试剂盒(Wako Pure Chemical Industries Ltd., Osaka, Japan)检测血清丙氨酸氨基转移酶(ALT)的活性。结果以Karmen单位[21]显示。
肝丙二醛测定。使用BIOXYTHCH MDA-586测定试剂盒(OxisResearch, Oregon, USA)确定肝MDA水平。简要地说,冷冻的缺血肝脏组织在丁基羟甲苯存在下均质化。离心后,上清液中的游离MDA通过与N-甲基-2-苯基吲哚的化学反应转化为稳定的碳氰染料(最大吸收在586 nm)。蛋白质浓度通过BCA蛋白测定法(Pierce, Rockford, IL, USA)使用BSA作为标准来确定。MDA水平按蛋白质标准化(pmol/mg)。
结果
通过HE染色进行组织病理学检查
为了调查吸入氢气(H2)是否保护肝脏免受肝缺血再灌注损伤,我们对经过缺血再灌注处理的小鼠肝脏切片进行了组织病理学分析,这些小鼠有或没有氢气。在没有氢气的情况下遭受缺血再灌注伤害时,整个切片观察到严重的变性,且区域性细胞质空泡化主要发生在中心小叶区域(图1中的白色区域)。使用NIH Image软件的定量分析显示,变性区域平均占据了整个切片的65%(图2)。吸入氢气明显减弱了缺血再灌注引起的变性,且保护效果呈浓度依赖性。此外,为了排除这种减轻可以通过任何气态分子实现而不特定于氢气的可能性,我们用氦气(He)代替氢气处理小鼠。He气体并未显示出对肝缺血再灌注损伤的任何保护效果(图1)。这些结果表明,氢气气体在低至2-4%的浓度下减少肝缺血再灌注损伤。氢气的最佳浓度与之前的结果[16]一致。
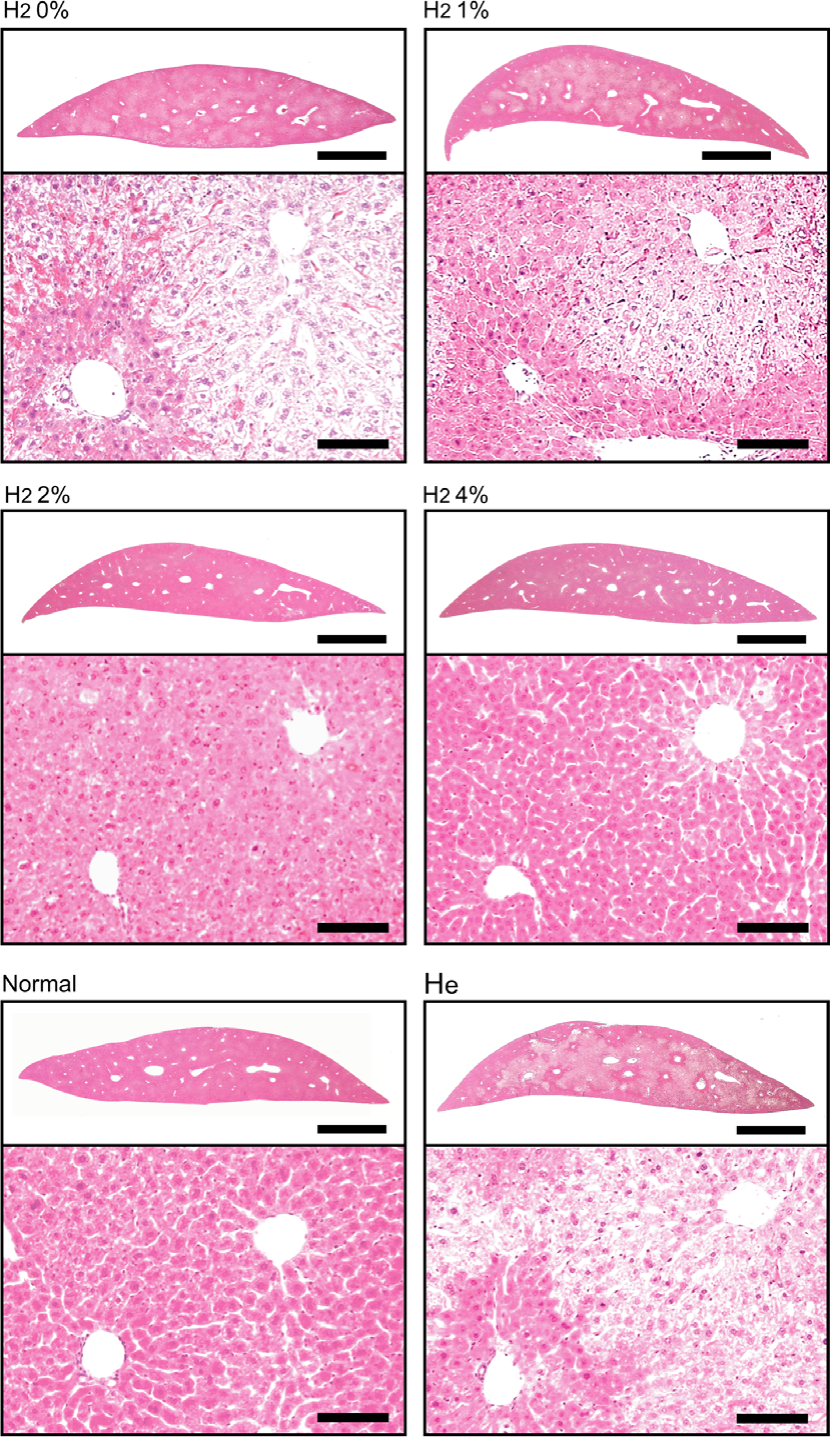
图1. 吸入氢气抑制缺血再灌注损伤。在麻醉气体下,小鼠遭受90分钟的缺血伤害,随后进行180分钟的再灌注。缺血的肝脏被移除用于固定。制备了石蜡切片并进行HE染色。为了让小鼠吸入氢气,将氢气在再灌注前10分钟供应到麻醉气体中,并持续供应直到再灌注结束。小鼠也吸入了4%的氦气代替氢气。代表性的图片显示。比例尺:2毫米(上图)和100微米(下图)。
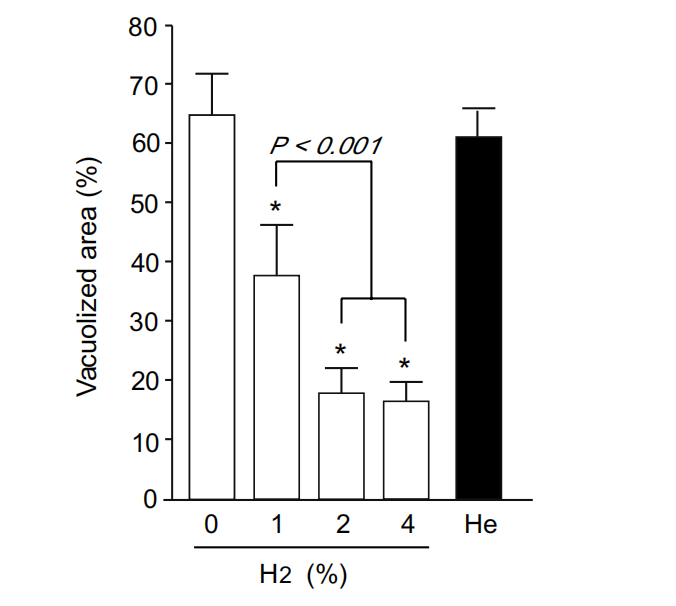
图2. 肝缺血再灌注引起的空泡化区域的定量分析。如图1所示(上图),在有无氢气的情况下经受缺血再灌注的小鼠的HE染色肝脏切片的全貌图像(每个组n=6)进行分析,以评估由空泡化区域(图1中的白色区域)占据的相对面积,使用NIH image软件。也分析了用4%氦气代替氢气处理的小鼠(n=6)的全貌图像。通过单因素方差分析进行统计分析后,数据以均值和标准差(垂直条形图)呈现。
血清丙氨酸氨基转移酶
为了生化验证组织学检查的结果,我们在每个实验组中测量了血清ALT水平。与不使用氢气气体的处理相比,吸入氢气气体抑制了肝脏ALT释放的一半到三分之一,而He气体不能降低血清ALT水平(图3)。
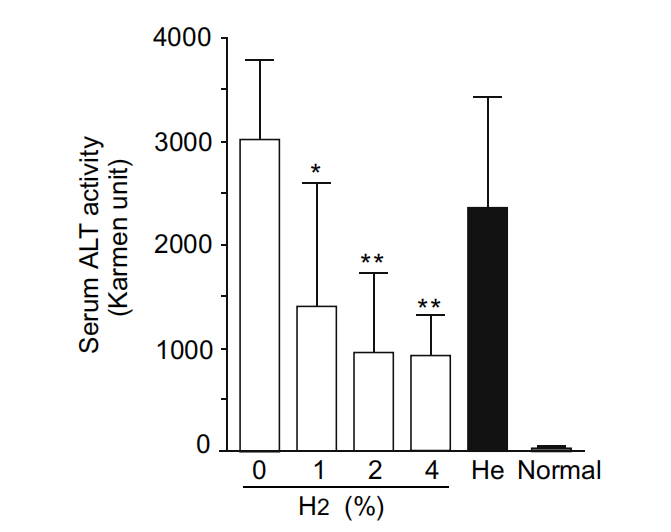
图3. 氢气降低了血清ALT水平。小鼠(每个组n=6)在有无氢气的情况下经受缺血再灌注,并检测它们的血清ALT活性(以Karmen单位[21]表示)。也分析了用4%氦气代替氢气处理的小鼠(n=6)和未经任何处理的正常小鼠(n=6)。结果以均值和标准差呈现。使用单因素方差分析进行统计分析。*P < 0.05; **P < 0.005,与0% 氢气气体相比。
在肝脏组织中的丙二醛(MDA)水平
MDA水平被广泛用作自由基介导的脂质过氧化损伤的指标。我们在肝脏中测量了MDA水平,因为我们之前的研究表明氢气减弱了氧化应激[16]。如图4所示(0% 氢气气体),缺血再灌注伤害增加了肝脏MDA水平。相比之下,吸入氢气气体显著降低了MDA水平,几乎降至正常水平。用氦气代替氢气吸入略微降低了MDA水平,但与对照组(0% 氢气气体)相比不显著。
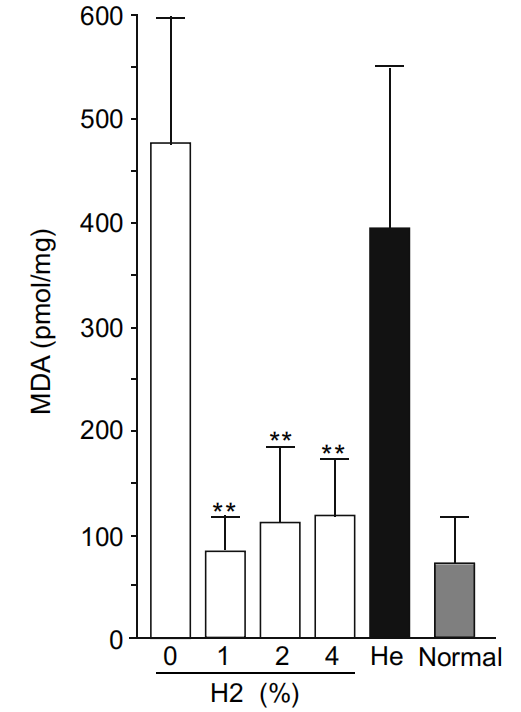
图4. 氢气显著降低了肝脏MDA水平,这是氧化应激的标志物。小鼠(每个组n=6)在有或无氢气的情况下经受缺血再灌注。缺血的肝脏被移除并在丁基化羟甲苯存在下均质化。离心后,上清液中的游离MDA被确定。用4%的氦气代替氢气处理的小鼠(n=6)和未经任何处理的正常小鼠(n=6)也被分析。游离MDA水平根据上清液中的蛋白质含量进行标准化。结果以均值和标准差呈现。使用单因素方差分析进行统计分析。∗∗P<0.0001,与0% 氢气气体相比。
讨论
已有报道指出,肝脏温性缺血再灌注伤害包括两个阶段[22][23][24][25]。在初始阶段,Kupffer细胞在再灌注后2小时内由缺血激活产生活性氧(ROS),导致急性肝细胞损伤。随后的晚期发生在再灌注后6小时,其中众所周知的ROS来源——中性粒细胞[24][26][27][28][29],在肝脏中积聚,更深刻地发展肝损伤。值得注意的是,肝细胞和窦状内皮细胞中减少的线粒体呼吸活动可以在初始阶段导致ROS的产生[30]。因此,抑制或减少初始阶段的ROS产生/积累对于减轻肝脏缺血再灌注损伤非常重要。
羟基自由基是细胞内产生的ROS中反应性最强的产物。据推测,生物系统中的羟基自由基是由超氧阴离子和过氧化氢通过哈伯-魏斯反应生成的,或者由过氧化氢通过芬顿反应生成[31][32]。消除羟基自由基在生物学上很重要,因为超氧阴离子和过氧化氢分别被抗氧化防御酶、超氧化物歧化酶和过氧化物酶或谷胱甘肽过氧化物酶解毒;然而,没有酶可以解毒羟基自由基。包括葡萄糖、甘露醇、甲酸盐、硫脲和二甲基亚砜在内的各种物质已被报道为羟基自由基清除剂[33][34]。
由于氢分子是电中性的,并且比氧分子小得多,预计氢分子将容易穿透细胞和细胞内膜,这些膜阻止水溶性抗氧化剂进入细胞和诸如线粒体这样的细胞器,而线粒体是ROS产生的主要来源。
在最近的一项研究中,我们证明了在吸入氢气后血液中检测到了氢分子[16]。氢分子只与羟基自由基反应,但不能与反应性较低的氧化剂如过氧化氢反应[16]。羟基自由基容易与包括DNA、蛋白质和脂质在内的细胞大分子反应,发挥强烈的细胞毒性作用。众所周知,羟基自由基与脂质的反应导致脂质过氧化。花生四烯酸和亚油酸的过氧化产生MDA和羟基壬烯醛(HNE)。在本研究中,我们展示了氢气显著抑制了肝脏缺血再灌注伤害诱导的MDA产生。我们还证明了氢气抑制了大脑缺血再灌注伤害诱导的HNE产生,并且氢气清除了在培养细胞中产生的羟基自由基[16]。这些结果表明,氢气消除了肝脏缺血再灌注伤害诱导的羟基自由基。
氢气已在医疗应用中用于预防深潜员的减压病(DCS)[35]。血管内气泡的发展是深潜员DCS的主要原因。氮气比氦气或氢气更容易在压力条件下产生气泡[36]。因此,深潜员通常呼吸氧气和氦气或氢气的二元混合物来预防DCS[37]。在本研究中,我们展示了氦气不能替代氢气。因此,在预防DCS方面,氢气和He不作为抗氧化剂起作用。氢气将作为抗氧化剂在广泛的医疗应用中使用。
https://wap.sciencenet.cn/blog-41174-1429529.html
上一篇:病毒残余可能是长新冠的原因
下一篇:氢水减少SMP30/GNL敲除小鼠脑片超氧离子产生【氢医学经典】